Diese Seite dient der Selbstkontrolle für diejenigen, welche die Aufgaben zu den Seiten 112-113 bearbeitet haben und nun sehen wollen, wie ich geantwortet hätte.
| Diese Tabelle zeigt meine Lösungsvorschläge zu den Aufgaben, bei denen es um die Regulation von Enzym-gesteuerten Stoffwechselreaktionen geht. |
| 1 | Erkläre die Notwendigkeit der Regulation der zellulären Stoffwechselwege! |
| Würden die zellulären Stoffwechselwege nicht reguliert, dann könnten gerade erst synthetisierte Substanzen sofort wieder abgebaut werden. Stoffwechselprodukte könnten sich auch übermäßig anhäufen, wenn über den Bedarf hinaus produziert würde. Das wäre mindestens eine Resourcenverschwendung. Eine Anhäufung bestimter Zwischenprodukte muss aber auch deshalb verhindert werden, weil sie giftig oder auf andere Weise schädlich sind. |
| 2 | Prüfe, ob es bei maximaler Reaktionsgeschwindigkeit überhaupt einen Moment geben kann, an dem alle Enzyme ein Substrat-Molekül gebunden haben! |
| Enzyme binden ihre Substrate nur für kurze Zeit, wandeln sie in ihre Produkte um und stoßen diese dann ab. Deshalb kann ein Enzym selbst bei maximaler Reaktionsgeschwindigkeit nicht immer ein Substrat gebunden haben. Und es ist praktisch unmöglich, dass zu irgendeinem Zeitpunkt alle Enzyme gerade ein Substrat und nicht ein Produkt oder gar nichts gebunden haben. |
| 3 | Entwickle eine kleine Arbeitshypothese und ein denkbares Experiment zur Frage des Substrat-Überschusses, der zum Erreichen der maximalen Reaktionsgeschwindigkeit eines Enzyms erforderlich ist! |
| Da Enzym und Substrat sich nur durch zufällige Diffusion finden und weil das zum Erreichen der maximalen Reaktionsgeschwindigkeit möglichst schnell gehen soll, muss es einen sehr großen Substrat-Überschuss geben. Wie groß dieser Überschuss sein muss, lässt sich mit einer Reihe von Experimenten ermitteln. Die gleiche Menge Enzym wird in Lösungen mit unterschiedlich großen Substrat-Überschüssen gegeben und dann wird jeweils nach bestimmten Zeitspannen die Produkt-Konzentration gemessen. Die Sättigungskonzentration ist dann erreicht, wenn eine weitere Erhöhung der Substrat-Konzentration keinen Geschwindigkeitszuwachs mehr bringt. |
| 4 | Beschreibe die kompetitive Hemmung von Enzymen! |
| Bei der kompetitiven Hemmung konkurriert ein kompetitiver Inhibitor mit dem eigentlichen Substrat um die Bindung am aktiven Zentrum des Enzyms und verlangsamt dadurch die Umsetzung des Substrates. |
| 5 | Erkläre, warum laut Abbildung 112.1 B trotz kompetitiver Hemmung nahezu die maximale Reaktionsgeschwindigkeit einer ungehemmten chemischen Reaktion erreichbar ist! |
| Wenn der Inhibitor reversibel bindet, dann kann er durch einen extremen Substrat-Überschuss fast völlig verdrängt werden, sodass er die chemische Reaktion kaum noch behindert. |
| 6 | Skizziere Abbildung 112.1 B ergänzt um den Fall einer irreversiblen kompetitiven Hemmung! |
|
|  |
Wenn der kompetitive Inhibitor irreversibel am aktiven Zentrum bindet, dann reduziert er die Anzahl der aktiven Enzym-Moleküle und damit auch die maximal erreichbare Reaktionsgeschwindigkeit, die deshalb früher erreicht wird. In einer Zelle würden allerdings neue Enzym-Moleküle produziert. Dadurch könnte während des Experimentes die maximal erreichbare Reaktionsgeschwindigkeit kontinuierlich zunehmen und die Kurve läge insgesamt etwas höher. Außerdem stimmen diese Kurven nur für nichtkooperative Enzyme. Die meisten allosterischen Enzyme bilden aber Komplexe aus mehreren Enzymen, die das Binden eines ersten Substrates erschweren, während sie die Bindung der letzten Substrate erleichtern. Die Kurven nehmen deshalb meistens eine S-Form mit anfangs flacherer und später erhöhter Steigung an. |
| 7 | Prüfe die Behauptung unseres Buches, Blei-Ionen und das rechts dargestellte Nervengift E605 bewirkten eine nichtkompetitive Hemmung! |
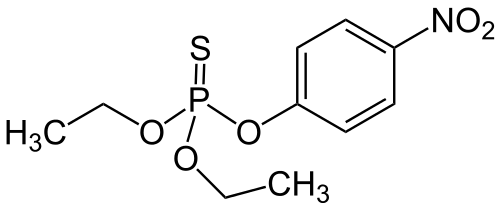 |
| Kennzeichnend für eine nichtkompetitive Hemmung ist, dass der Inhibitor nur die Umsetzung, nicht aber die Bindung des Substrates an das Enzym behindert. Man kann auch sagen, dass bei einer nichtkompetitive Hemmung der Inhibitor das Enzym ebenso gut bindet wie den Enzym-Substrat-Komplex. Leider erweckt unser Buch mangels nachvollziehbarer Erklärungen den Eindruck, eine Hemmung sei auch dann nichtkompetitiv, wenn das Substrat nicht mit dem Inhibitor konkurrieren kann, weil der Inhibitor irreversibel an das aktive Zentrum bindet. Man muss schon sehr genau lesen und selber recherchieren, um die Sache aufzuklären.
In unserem Buch wird behauptet, das Nervengift Parathion (E605) verändere das aktive Zentrum der Acetylcholinesterase, indem es (dort) irreversibel an die Aminosäure Serin binde. In Wirklichkeit wird das aktive Zentrum der Acetylcholinesterase aber nicht von Parathion verändert, sondern durch dessen Stoffwechselprodukt (Metabolit) Paraoxon (E600). Und das geschieht auch nicht durch eine Bindung von Paraoxon, sondern das aktive Zentrum der Acetylcholinesterase wird durch Paraoxon phosphoryliert. Paraoxon überträgt eine relativ kleine Phosphat-Gruppe auf ein Serin im aktiven Zentrum. So hätte unser Buch das erklären sollen, denn für eine nichtkompetitive Hemmung durch Bindung am aktiven Zentrum wären Parathion und Paraoxon zu groß. Bei einer Bindung am aktiven Zentrum hätten sie die Bindung des Substrates behindert. Trotzdem kann ein am aktiven Zentrum gebundenes Substrat die Bindung einer Phosphat-Gruppe behindern. Also gibt es sehr wohl eine Konkurrenz um das aktive Zentrum, auch wenn fester bindende Nervengifte oder Bestandteile von ihnen dabei einen Vorteil haben, sobald sie gebunden sind.
Bei den kleinen Blei-Ionen mag es stimmen, dass sie die Bindung des Substrates nicht behindern. Es kann aber nicht sein, dass Blei-Ionen völlig irreversibel binden. Und es ist bekannt, das Blei-Ionen meistens allosterisch binden. Es ist allerdings egal, ob Blei-Ionen am aktiven Zentrum oder einer anderen Stelle eines Enzyms eine Schwefelbrücke (Disulfidbrücke) auflösen, denn dadurch kann die Tertiärstruktur eines Enzyms verloren gehen und viele Proteine sind nicht in der Lage, selber wieder die richtige räumliche Struktur anzunehmen. Wenn allerdings die Auflösung der Tertiärstruktur am aktiven Zentrum die Ursache für eine irreversible Hemmung der Enzym-Aktivität wäre, dann wäre es sehr unwahrscheinlich, dass davon nicht auch die Bindung des Substrats betroffen wäre. Und dann handelte es sich nicht um eine nichtkompetitive Hemmung.
Entscheidend ist aber, dass es tatsächlich Ausnahmefälle gibt, in denen auch ein am aktiven Zentrum bindendes Ion oder kleines Molekül ein nichtkompetitiver Inhibitor sein kann, wenn es die Bindung des Substrates nicht behindert, sondern lediglich die Reaktionsgeschwindigkeit reduziert. |
| 8 | Entwickle eine ausführliche Arbeitshypothese zu der Frage, wie es zu einer wirklich nichtkompetitiven Hemmung kommen könnte! |
| Damit eine Enzym-Inhibition wirklich nichtkompetitiv ist, muss der Inhibitor außerhalb des aktiven Zentrums an das Enzym binden. Nur so kommt es nicht zu einer Konkurrenz um das aktive Zentrum. Damit es trotzdem zu einer Hemmung der chemischen Reaktion am aktiven Zentrum kommt, muss der Inhibitor das Enzym so verändern, dass es das Substrat schlechter bindet oder die chemische Reaktion weniger gut katalysieren kann oder die Produkte nicht loslässt. |
| 9 | Allosterisch kommt vom griechischen allos = anderer und stereos = Ort, räumlich, körperlich, fest oder starr. Prüfe, wie gut das zu der Behauptung unseres Buches passt, eine allosterische Regulation sei eine reversible Beeinflussung der Enzym-Aktivität! |
| Die charakteristische Eigenschaft einer allosterischen Regulation ist nicht, dass sie reversibel ist. Das trifft schließlich auch auf die kompetitive Hemmung
zu. In Wirklichkeit bedeutet allosterisch, dass der Inhibitor an einem anderen Ort bindet und dass allosterisch regulierte Enzym unterschiedliche räumliche Strukturen annehmen können. |
| 10 | Prüfe, ob bei einer allosterischen Regulation die Bindung des Regulatormoleküls (Effektors) wirklich reversibel sein muss! |
| Eine Enzym-Regulation ist dann eine allosterische, wenn ein Effektor an ein allosterisches Zentrum bindet. Eine solche Bindung ist zwar meistens reversibel, muss es aber nicht sein. Besonders von natürlichen Giften ist zu erwarten, dass manche auch irreversibel allosterisch regulieren. |
| 11 | Das Buch beschreibt ein (einziges) allosterisches Zentrum, dessen Bindung an das Regulatormolekül spezifisch sei. Andererseits zeigt die Abbildung 113.1, dass das allosterische Enzym Phosphofructokinase durch die beiden sehr unterschiedlichen Moleküle ADP und Zitronensäure inhibiert wird. Nimm Stellung zu diesen beiden Aussagen! |
| Auch in diesem Fall widersprechen sich Text und Abbildung. Gäbe es tatsächlich nur ein allosterisches Zentrum, dann könnte es im Falle der Phosphofructokinase nicht spezifisch sein. In Wirklichkeit hat dieses Enzym mehrere allosterische Zentren, die außerdem jeweils mehrere Effektoren binden können. |
| 12 | Beschreibe, wie das Buch die Wirkungen von Aktivatoren und Inhibitoren an allosterische Zentren erklärt und prüfe, ob das wirklich die einzige Möglichkeit ist! |
| Unser Buch erklärt die Wirkungen allosterischer Aktivatoren und Inhibitoren mit einer verbesserten bzw. verschlechterten Passung des Substrates am aktiven Zentrum. Das ist aber natürlich nicht der einzig mögliche Mechanismus. Statt der Bindung des Substrates können auch katalytsche Wirkungen oder die Freisetzung von Produkten verbessert oder verschlechtert werden. Generell scheint es den Buchautoren an Überblick und Fantasie zu mangeln, sodass sie ständig mögliche Alternativen ignorieren. Wer mit solchen Büchern arbeiten muss, sollte sich also lieber auf seinen eigenen Verstand verlassen und diesen zu einem kritischen Geist trainieren. |
| 13 | Definiere die im Buch hervorgehobenen Begriffe Stoffwechselweg und Schlüsselenzym! |
| Nicht zum ersten Mal benutzt unser Buch Begriffe, ohne sie zu erklären. Immerhin lässt sich aus dem Zusammenhang schließen, dass mit einem Stoffwechselweg eine Abfolge von Stoffwechselreaktionen gemeint ist, bei denen jeweils das Produkt des Vorgängers zum Substrat des Nachfolgers wird. Hinsichtlich des Schlüsselenzyms gibt das Buch jedoch überhaupt keinen Hinweis. Wahrscheinlich soll man aus bekannten Begriffen wie Schlüsselspieler, Schlüsselspiel oder Schüsselerlebnis schließen, dass ein Schlüsselenzym ein entscheidendes sei. Aber woher sollen Lernende wissen, was das Schlüsselenzym so besonders wichtig macht? Sie können es nicht - Opfer planloser didaktischer Reduktion, die eher der Bequemlichkeit von Autoren als dem Wohl der Lernenden dient. Was ich dazu recherchiert habe, steht im Glossar. |
