






Dieser Hypertext fasst unserer Buchseiten 106-114 zusammen.
Klickt man im Inhaltsverzeichnis auf die blauen Pfeile, so springt man innerhalb des Textes nach unten in das entsprechende Kapitel. Mit einem Klick auf die Kapitelüberschrift springt man vom Inhaltsverzeichnis direkt in ein ausführlicheres Kapitel eines anderen Textes.
Die folgenden Abschnitte fassen zusammen, was die Seiten 106-114 unseres Zellbiologie-Schulbuches zum Thema Enzyme vermitteln. Meine Zusammenfassungen dieser Seiten sollen aber nur als Beispiel und der Kontrolle dienen. Damit man sich nicht um eine wichtige Gelegenheit zur Übung selbständigen Denkens, Analysierens und Formulieres bringt, sollte man vor meinen Zusammfassungen die Buchseiten selber lesen und versuchen, wesentliche Informationen in eigenen Worten so knapp wie möglich und so ausführlich wie nötig zusammenzufassen. Das Werkzeug dafür hat jeder gesunde Mensch in seinem Gehirn. Eine weitere Möglichkeit aktiver Erarbeitung dieser Inhalte bieten klausurähnliche Aufgaben.
Bau und Wirkungsweise von Enzymen - Seiten 106-107
|
|---|
Mit folgendem Link findet Du klausurähnliche Aufgaben zu den Buchseiten 106-107.
Im buchunabhängigen Lerntext Stoffwechselphysiologie gibt es ein Kapitel Enzyme.
Unsere Zellen sind keine feuerfesten Reagenzgläser. Man kann sie nicht einfach erhitzen, um chemische Reaktionen möglich oder schneller zu machen. Damit die unzähligen chemischen Reaktionen in unseren Zellen bei einer Körpertemperatur von 37°C ablaufen können, brauchen wir für fast jede chemische Reaktion ein eigenes Enzym.
Enzyme gehören zu den Proteinen und sind Biokatalysatoren. Biokatalysatoren sind von Lebewesen produzierte Katalysatoren. Katalysatoren senken selektiv bei bestimmten chemischen Reaktionen die dafür notwendigen Aktivierungsenergien. Dadurch steigern Enzyme die Reaktionsgeschwindigkeit.
Aktivierungsenergie ist die Energiemenge, die man Ausgangsstoffen (Edukten) zuführen muss, damit sie zu den Endprodukten (Produkten) chemisch reagieren können. Da sie zuerst zugeführt werden muss, wirkt sie wie eine Barriere, die ein spontanes Ablaufen einer chemischen Reaktion verhindert. Deshalb kann man die Aktivierungsenergie auch als Hürde und die Höhe der Aktivierungsenergie als die Höhe des zu überwindenden Hindernisses betrachten. Diese Hürde Aktivierungsenergie ist umso geringer, je höher während einer chemischen Reaktion die Temperatur der Umgebung ist. Deshalb laufen viele chemische Reaktionen doppelt bis dreimal so schnell ab, wenn man die Reaktionstemperatur um 10°C erhöht.
Ein Beipiel für eine Enzym-gesteuerte chemische Reaktion ist die Spaltung des Disaccharids Maltose in zwei Moleküle Glucose durch ein Enzym namens Maltase. Hier bezeichnet man den Ausgangsstoff Maltose chemisch als das Edukt einer chemischen Reaktion. Biochemisch spricht man vom Substrat eines Enzyms, das in diesem Fall Maltase heißt.
Das direkt an der chemischen Reaktion des Substrates beteiligte aktive Zentrum des Enzyms muss so exakt zur Form des Substrates passen wie ein Schloss zu einem Schlüssel. Das ist der Grund für die Substratspezifität. So nennt man die Eigenschaft eines Enzyms, nur ganz bestimmte Substrate zu verarbeiten. Für die Substratspezifität sorgen die funktionellen Gruppe der Aminosäuren im aktiven Zentrum.
Enzym und Substrat verbinden sich vorübergehend zu einem Enzym-Substrat-Komplex. Dabei ändern beide Partner etwas ihre Form und dem Substrat wird dadurch eine bestimmte chemische Reaktion erleichtert. Das ein Enzym von mehreren oder vielen möglichen chemischen Reaktionen eines Substrates nur eine ganz bestimmte katalysiert, nennt man Wirkungsspezifität.
Als Produkte oder Reaktionsprodukte entlässt die Maltase zwei Glucose-Moleküle. Das Enzym geht am Ende unverändert aus der chemischen Reaktion hervor.
Eine energetische Kopplung ist immer dann notwendig, wenn die Produkte einer chemischen Reaktion energiereicher sind als die Edukte. Solche chemischen Reaktionen laufen nämlich nur unter Zufuhr von Energie ab. Und diese Energie wird von einer zweiten chemischen Reaktion geliefert, deren Produkte energieärmer sind als die Edukte. Dabei kann es zu einer Übertragung der chemischen Energie von der zweiten auf die erste chemische Reaktion kommen. Bei einem alternativen Mechanismus wird zunächst wenigstens eines der Edukte durch den Abbau eines sehr energiereichen Stoffes aktiviert (energiereicher gemacht). Dadurch wird die Eduktseite energiereicher als die Produktseite und die chemische Reaktion kann auch ohne weitere Energiezufuhr ablaufen.
So wird beispielsweise die chemische Energie eines ATP-Moleküls genutzt, um ein Phosphat auf das Edukt Glucose zu übertragen. Dadurch entsteht das energiereichere Zwischenprodukt Glucose-1-Phosphat. Dieses kann dann in einer zweiten chemischen Reaktion mit dem zweiten Edukt Fructose zum Produkt Saccharose reagieren. Übrig bleiben ADP und ein Phosphat, die in einem Mitochondrium wieder zu energiereichem ATP verbunden werden.
Einteilung der Enzyme - Seite 108
|
|---|
Mit folgendem Link findet Du klausurähnliche Aufgaben zur Buchseite 108.
Viele Enzym-Namen wirken auf den ersten Blick übertrieben kompliziert. Ungeübten erscheinen sie unlernbar und kaum aussprechbar, weil sie die Struktur der Namen sowie die dahinter steckende Logik nicht erkennen. Dabei setzen sich die wissenschaftlichen Namen der Enzyme nach einem einfachen Prinzip zusammen. Nach der internationalen Nomenklatur der Enzyme beginnt der Name eines Enzyms mit dem Namen seines Substrates. Es folgt der Name der vom Enzym katalysierten chemischen Reaktion. Schließlich wird noch die allen Enzymen gemeinsame Endung: "ase" angehängt. So wird beispielsweise das Substrat Malat von der Malatdehydrogenase dehydrogeniert, wobei das "de" für Wegnehmen steht und "Hydrogen" das englische Wort für Wasserstoff (vom lateinischen Hydrogenium) ist.
Fehlt Enzym-Namen die Endung "ase", dann handelt es sich um Trivialnamen. Beispiele dafür sind die Verdauungsenzyme Pepsin, Trypsin und Chymotrypsin. Naturwissenschaftler benutzen außer dem Namen zusätzlich eine Nummer (z.B.: 1.1.1.1 für die Alkohol-Dehydrogenase oder 2.4.1.1 für die Glycogen-Phosphorylase), mit der wir uns in der Schule aber nicht beschäftigen müssen.
Aufgrund ihrer Reaktionstypen werden Enzyme in die 6 Hauptklassen Oxidoreduktasen, Transferasen, Hydrolasen, Lyasen, Isomerasen und Ligasen eingeteilt.
Einflüsse auf die Enzymkatalyse - Seite 109
|
|---|
Mit folgendem Link findet Du klausurähnliche Aufgaben zur Buchseite 109.
Das Temperaturoptimum einer Enzym-Reaktion ist die Temperatur, bei welcher die Reaktionsgeschwindigkeit maximal ist. Mit abnehmender Reaktionstemperatur nimmt die Aktivierungsenergie zu. Mit abnehmender Temperaturen nimmt deshalb auch die Reaktionsgeschwindigkeit ab. Selbst extrem tiefe Temperaturen schaden Enzymen nicht, sondern inaktivieren sie nur reversibel. Bei Temperaturen oberhalb des Temperaturoptimums werden die meisten Enzyme zunehmend denaturiert. Sie verlieren deshalb ihre Aktivität dauerhaft, also irreversibel.
Weil Lebewesen mit nicht optimal arbeitenden Enzymen im Kampf ums Überleben und erfolgreiche Fortpflanzung Nachteile haben, liegen die Temperaturoptima der Enzyme normalerweise genau am oberen Ende der Temperaturen, bei denen sie normalerweise arbeiten müssen.
Der pH-Wert hat ebenfalls einen großen Einfluss auf die Aktivität vieler Enzyme. Außer dem Temperaturoptimum haben Enzyme auch ein pH-Optimum, bei dem die Enzymaktivität ein Maximum erreicht. Bei niedrigeren und bei höheren pH-Werten sinkt die Enzymaktivität immer weiter ab. Diese Inaktivierung ist bei nicht zu stark abweichenden pH-Werten noch reversibel. Wird seine Umgebung noch saurer oder noch alkalischer, dann wird die Inaktivierung eines Enzyms zunehmend irreversibel.
Es kann aber auch ein Organ seinen pH-Wert an die optimalen Arbeitsbedingungen der in ihm aktiven Enzyme anpassen. So muss es im Magen sehr sauer sein, weil seine Enzyme die zu verdauenden Eiweiße nur zerlegen können, wenn diese Eiweiße durch die Säure aufgelockert bzw. denaturiert wurden. Im Gegensatz zum Pepsin im Magen konnten sich anscheinend die Verdauungsenzyme des Dünndarms nicht an eine extrem saure Umgebung anpassen. Ihre pH-Optima liegen im alkalischen Bereich. Also müssen Bauchspeicheldrüse und Gallenblasse stark alkalische Sekrete (Bauchspeichel und Galle) in den Zwölffingerdarm spritzen, damit die Enzyme des Dünndarms arbeiten können.
Statt lebender Mikroorganismen werden heute oft isolierte Enzyme in der Lebensmittelverarbeitung, Pharmaindustrie, Chemie sowie beim Spülen und Waschen eingesetzt. So lässt sich die Wirkung besser kontrollieren und ein einzelnes Enzym kann leichter als ein ganzer Organismus an extreme Rekationsbedingungen angepasst werden. Dabei kann die Gentechnik helfen, Enzyme zu optimieren und sie relativ sauber in Bakterien zu produzieren, anstatt sie aus ekligen oder potentiell gefährlichen, tierischen Geweben zu isolieren. Ein weiterer Vorteil gentechnisch hergestellter Enzyme ist, dass man deren Eigenschaften mit Hilfe der Gentechnik verändern und ungeachtet tierischer Bedürfnisse viel leichter als ganze Zellen für bestimmte Einsatzfelder optimieren und genau an technische und menschliche Bedürfnisse anpassen kann. Andererseits birgt diese Chance auch das Risiko, dabei versehentlich gefährliche Eigenschaften zu erhalten und diese bei ungenügenden Tests nicht rechtzeitig zu erkennen.
Aktivierung und Hemmung enzymatischer Reaktionen - Seiten 112-113
|
|---|
Mit folgendem Link findet Du klausurähnliche Aufgaben zu den Buchseiten 112-113.
Zellen müssen immer die gerade benötigten Stoffe und möglichst nur diese herstellen. Würden die zellulären Stoffwechselwege nicht reguliert, dann könnten gerade erst aufwändig synthetisierte Substanzen sofort wieder abgebaut werden. Stoffwechselprodukte könnten sich auch übermäßig anhäufen, wenn über den Bedarf hinaus produziert würde. Das wäre mindestens eine Resourcenverschwendung. Eine Anhäufung bestimter Zwischenprodukte muss aber auch deshalb verhindert werden, weil sie giftig oder auf andere Weise schädlich sind.
Zellen regulieren ihre Stoffwechselreaktionen langfristig durch die Regulation von Transkription und/oder Translation. Dadurch werden nur die jeweils benötigten Enzyme hergestellt. Zusätzlich werden nicht mehr benötigte Enzyme durch Proteasome abgebaut. Die Regulation vorhandener Enzyme erfolgt meistens durch einen Effektor (Ion oder Molekül), der die Geschwindigkeit einer Enzym-katalysierten chemischen Reaktion beeinflusst. Wenn der Effektor die Reaktionsgeschwindigkeit drosselt, nennt man ihn Inhibitor und seinen Effekt Inhibition. Erhöht hingegen der Effektor die Reaktionsgeschwindigkeit, nennt man ihn Aktivator und seinen Effekt Aktivierung.
Die unsystematische, mißverständliche, irreführende und teilweise schlicht falsche Darstellung von nur drei Mechanismen der Enzym-Regulation durch unser Buch ersetze ich durch eine systematische Einteilung der in Wirklichkeit sehr vielen Möglichkeiten. Man kann die Möglichkeiten der Regulation Enzym-gesteuerter chemischer Reaktionen nach verschiedenen Merkmalen einteilen:
Diese unterschiedlichen Merkmale der Regulation von Stoffwechselreaktionen sind vielfältig miteinander kombinierbar. Manche Kombinationen haben bestimmte Namen, die aber nicht immer wirklich eindeutig sind. Wird beispielsweise eine reversible oder irreversible Stoffwechselreaktion durch einen isosterisch bindenden Inhibitor unvollständig und reversibel inhibiert, dann nennt man das eine kompetitive Hemmung. Weil das Substrat und der Inhibitor um das aktive Zentrum konkurrieren und weil Konkurrenz auf Englisch competition heißt, nennt man den Inhibitor kompetitiven Hemmstoff. Weil die Bindung des Hemmstoffes an das aktive Zentrum des Enzyms ebenso reversibel wie die des Substrates ist, wird dessen Umsetzung durch das Enzym bei der kompetitiven Hemmung nicht vollständig unterdrückt und kann durch eine Erhöhung der Substrat-Konzentration überwunden werden.
Bis zu den jeweiligen Sättigungskonzentrationen nehmen die Reaktionsgeschwindigkeiten Enzym-katalysierter chemischer Reaktionen zu, wenn die Konzentrationen ihrer Substrate und Coenzyme (falls solche benötigt werden) zunehmen. Die Sättigungskonzentration ist die Substrat-Konzentration, ab der eine weitere Steigerung der Substrat-Konzentrationen nicht mehr zu einer Zunahme der Reaktionsgeschwindigkeit führt, weil bereits jederzeit alle freien Enzym-Makromoleküle ausreichend mit Substrat versorgt sind.
Unterschiedlich wird der Begriff "nichtkompetitive Hemmung" benutzt. Unser Buch versteht darunter eine irreversible isosterische Bindung eines Inhibitors (Enzymgift), die zu einer irreversiblen Hemmung eines Enzyms führt. Man kann das mit einigem Wohlwollen als gerade noch nicht völlig falsch ansehen, weil das reversibel bindende Substrat einen irreversibel bereits gebundenen Inhibitor nicht mehr vom aktiven Zentrum verdrängen kann. Wirklich korrekt ist die Bezeichnung aber nicht, weil ein Substrat mit den noch nicht gebundenen Inhibitoren sehr wohl konkurrieren kann. So verhindert man die irreversible Inaktivierung eines Enzyms durch einen kovalent bindenden Inhibitor mit Hilfe eines großen Substrat-Überschusses. Die englisch-sprachige Wikipedia betont sogar ausdrücklich, dass JEDER nichtkompetitive Inhibitor an ein allosterisches Zentrum bindet. Viel häufiger wird der Begriff "nichtkompetitive Hemmung" deshalb auf eine allosterische Inhibitor-Bindung angewendet, weil der Inhibitor und das Substrat nicht um die selbe Bindungsstelle konkurrieren.
Allosterische Regulation nennen Biologen die Regulation einer Enzym-Aktivität durch die Bindung eines meist kleinen Effektor-Moleküls an einer anderen Stelle (dem regulativen oder allosterischen Zentrum) als dem aktiven Zentrum eines allosterischen Enzyms. Eine allosterische Regulation kann reversibel oder irreversibel, inhibierend oder aktivierend sowie kompetitiv, nichtkompetitiv oder unkompetitiv wirken. Kompetitiv wirkt sie, wenn die Bindung des Substrates am aktiven Zentrum die Bindung des Effektors am allosterischen Zentrum behindert und umgekehrt. Nicht-kompetitiv ist eine allosterische Regulation, wenn die Bindung an dem einen durch eine Bindung am anderen Zentrum nicht beeinflusst wird und die Aktivierung oder Inhibition auf andere Weise erfolgt. Unkompetitiv nennt man eine allosterische Regulation, wenn der Effektor nur an den Enzym-Substrat-Komplex bindet.
| Quartärstruktur einer Phosphofructokinase (Datenbanknummer 3O8O) | |
|---|---|
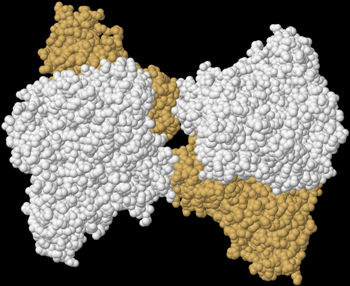 |
Wie komplex die Regulation eines Enzyms sein kann, zeigt das Beispiel der Phosphofructokinase 1 (Fructose-6-phosphat-kinase, EC2.7.1.11), welche beispielsweise in menschlichen Muskelzellen am Beginn der Glykolyse die Glucose-6-phosphat mit ATP zu Fructose-1,6-bisphosphat und ADP reagieren lässt. Dieses kooperative Tetramere bildende Enzym kann durch die allosterische Bindung von ATP, NADH, Zitronensäure, Fructose-2,6-bisphosphat und Fructose-1,6-diphosphat inhibiert sowie durch ADP, AMP, cAMP, ortho-Phosphat und Sulphat allosterisch aktiviert werden, wobei AMP und ATP um ihre Bindungsstelle am regulatorischen bzw. allosterischen Zentrum konkurrieren. Außerdem wird dieses Enzym durch niedrige pH-Werte gehemmt, zu denen es beispielsweise durch die Bildung von Milchsäure kommen kann. |
| Das von mir mit Hilfe der Daten der internationalen Protein Data Bank und dem Programm Jmol erzeugte Bild zeigt einen Enzym-Komplex aus 4 Phosphofructokinase-Molekülen der Backhefe Saccharomyces cerevisiae. | |
Die Stoffwechselreaktionen in lebenden Zellen sind miteinander zu Stoffwechselwegen verbunden, in denen das Produkt der einen zum Substrat der folgenden Reaktion wird. Oft wirkt ein Produkt eines der letzten als Inhibitor eines der ersten Enzyme eines Stoffwechselweges. So wird automatisch und effizient verhindert, dass zuviel produziert wird. Zum Beispiel hemmen im Stoffwechselweg aus Glykolyse, Citratzyklus und Atmungskette das Zwischenprodukt Zitronensäure und das Endprodukt ATP ihre Nachlieferung durch eine Inaktivierung der Phosphofructokinase 1. Das selbe Enzym kann aber auch durch die Substrate ADP und Phosphat aktiviert werden, die durch die Spaltung des Produktes ATP von Glykolyse, Zitratzyklus und Atmungskette entstehen.
Enzyme in der medizinischen Diagnostik - Seite 114
|
|---|
Mit folgendem Link findet Du klausurähnliche Aufgaben zur Buchseite 114.
Die Substratspezifität bewirkt, dass ein Enzym von den vielen Substanzen im komplexen Gemisch Blut nur eine bindet. Die Wirkungsspezifität führt dazu, dass man mit einem passenden Enzym dessen Substrat bzw. die zu untersuchende Substanz in genau ein Produkt umwandeln kann, welches sich qualitativ oder sogar quantitativ nachweisen lässt.
Die Ursache vieler gefährlicher Folgen einer noch nicht erkannten oder nicht gut behandelten Zuckerkrankheit ist die erhöhte Glucose-Konzentration im Blut der Betroffenen, denn dadurch werden die Blutgefäße geschädigt. (Am stärksten wirkt sich das in den Kapillaren aus, weil sie so dünn sind. Besonders betroffen sind daher von vielen Kapillaren durchblutete Organe wie Augen und Nieren sowie besonders empfindlich auf Sauerstoffmangel reagierende Zellen wie Nervenzellen.)
Das Enzym Glucoseoxidase katalysiert die Oxidation von Glucose. Weil diese chemische Reaktion nicht einfach direkt nachgewiesen werden kann, lässt man eine zweite Reaktion folgen, deren Nebenprodukt sich mit einem Indikator nachweisen läss. Unser Buch beschreibt das mißverständlich so, als ob erst durch die zweite chemische Reaktion H2O2 entstünde. Eine grafische Darstellung auf der selben Buchseite zeigt aber, dass H2O2 schon bei der ersten Reaktion entsteht. Demnach verwandelt sich die alpha-D-Glucose von alleine durch eine reversible Umlagerung in beta-D-Glucose, welche durch die Glucosereduktase zu D-Glucono-delta-lacton oxidiert wird. Dabei entsteht das H2O2. Das Enzym Peroxidase katalysiert dann die zweite chemische Reaktion, in welcher das H2O2 einen reduzierten hellblauen Farbstoff zu einem gelb-braunen Farbstoff oxidiert. Dabei wird aus dem H2O2 Wasser. Praktischerweise lassen sich alle benötigten Reagenzien für beide Reaktionen getrocknet auf einen Teststreifen aufbringen, auf den man einen Tropfen Blut gibt. Je nach der Konzentration der Glucose färbt sich daraufhin der Teststreifen mehr oder weniger stark. Die Glucose-Konzentration lässt sich dann durch Vergleich mit einer Farbskala oder mit Hilfe eines Fotometers bestimmen. (Leider nennt unser Buch den Namen des Farbstoffes nicht, aber eine andere Quelle bestätigt den Farbumschlag, während der Chemie, Biologie und Informatik-Lehrer Dr. Kay-Uwe Jagemann und das Buch: "Qualitätssicherung im Medizinischen Laboratorium" andere Farbumschläge beschreiben.)
Ein Bluttest zum Nachweis von Leberschäden könnte auf einer Farbreaktion beruhen, welche durch das von sterbenden Leberzellen freigesetzte Enzym Alanin-Amino-Transferase katalysiert.
Eine erhöhte Konzentration des Creatinkinase-Isoenzyms CK2 im Blut kann durch das Absterben von Herzmuskelzellen verursacht werden. Es kann dafür aber auch andere Ursachen wie Mutationen geben.
Lernstandskontrolle zur Enzymatik
|
|---|
Mit folgendem Link findet Du klausurähnliche Aufgaben, mit denen Du überprüfen kannst, wieviel von dem mit den Buchseiten 106-114 erarbeiteten Wissen wirklich in Deinem Gedächtnis angekommen ist. Lies die folgende Zusammenfassung nicht vor der Lösung der Aufgaben, sonst betrügst Du Dich selbst!
Es folgen Definitionen wichtiger Grundbegriffe für das Verständnis der Enzyme:
Zur Bestimmung der Reaktionsgeschwindigkeit muss man in regelmäßigen zeitlichen Abständen die Produktmenge oder Produkt-Konzentration und die Zeit oder Zeitspanne messen.
Bei sehr niedrigen Temperaturen werden Enzyme reversibel inaktiviert. Bei zu hohen Temperaturen werden die meisten Enzyme durch Zerstörung irreversibel inaktiviert.
Damit aus einer Stammzelle eine differenziertere Zelle wird, müssen in ihr bestimmte Gene an oder abgeschaltet werden.
Bei der kompetitiven Hemmung konkurriert ein Inhibitor mit einem Substrat um die Bindung an das aktive Zentrum des Enzyms. Bei der allosterischen Hemmung bindet der Inhibitor außerhalb des aktiven Zentrums, nämlich am allosterischen Zentrum und verändert dadurch die Struktur des Enzyms so, dass das aktive Zentrum weniger aktiv wird.
Roland Heynkes, CC BY-NC-SA 4.0