
Lerntext: "Chemische Grundlagen für das Verständnis der Biologie"
Roland Heynkes 8.7.2022, CC BY-SA-4.0 DE
If you cannot read German-language texts, you could try a translation into your native language with DeepL.

Große Teile der Biologie sind ohne ein chemisches Basiswissen nicht verständlich. Und man kommt weder in der Chemie noch in der Biologie noch in irgend einer anderen Naturwissenschaft klar, wenn man bestimmte Erkenntnisse der Physiker noch nicht nachvollzogen hat. Bevor wir uns ernsthaft mit den chemischen Grundlagen der Biologie beschäftigen, müssen wir deshalb einen Schnellkurs zu den wichtigsten physikalischen Grundlagen für das Verständnis aller Naturwissenschaften absolvieren. Diese zusätzliche Mühe lohnt sich, denn man versteht danach die Chemie und die Biologie viel leichter.
Folgt also dem Link zum Lerntext: "Physikalische Grundlagen für das Verständnis von Chemie und Biologie".

|
Ebenfalls sehr wichtig für das Verständnis von Chemie und Biologie sind die physikalischen Phänomene Diffusion und Osmose. Klausurartige Aufgaben für die selbständige Erarbeitung befinden sich im Übungsmodul Diffusion und Osmose. Die Informationen und Erklärungen befinden sich im Lerntext Diffusion und Osmose. |

|
Das pdf-Format hat den Vorteil, dass man damit auch auf einem Computer ohne Internet-Zugang arbeiten kann. Es hat aber den Nachteil, dass man keine Links zu den Erklärungen der Fachbegriffe im Glossar nutzen kann. Darum empfehle ich die Nutzung der Lerntexte im HTML-Format dieses Lerntextes, wenn ein Zugang zum World Wide Web besteht. |

Bis zum 10.10.2031 verfügbar ist die Fernseh-Dokumentation: "Wunderwelt Chemie 1 Die Bausteine der Natur
Bis zum 17.10.2031 verfügbar ist die Fernseh-Dokumentation: "Wunderwelt Chemie 2 Die Magie der Verwandlung
Bis zum 24.10.2031 verfügbar ist die Fernseh-Dokumentation: "Wunderwelt Chemie 3 Die Elemente des Lebens
Eine wunderbar verständliche und spannende Einführung in die Welt der Chemie liefert die im deutschen Fernsehen relativ oft wiederholte dreiteilige Dokumentation: "Elemente - Bausteine der Welt". Zumindest wer sich in der Oberstufe des Gymnasiums für die Fächer Chemie oder Biologie entscheidet, sollte sich diese Serie unbedingt ansehen. Im Internet habe ich sie leider nur in englichsprachigen Versionen gefunden, aber die Originale sind üblicherweise besser als die Übersetzungen.
Zum Nachlesen gibt es die ganze Serie hier: "Chemistry: A Volatile History".

Stoffe nennen wir in der Biologie weder Drogen noch das Material von Kleidern. Allgemein meinen wir damit eher physikalisch die Materie, aus der die Welt besteht. Wenn von bestimmten Stoffen die Rede ist, dann meinen Biologen damit wie die Chemiker bestimmte Materialien wie Luft und Wasser oder Substanzen wie Kochsalz und Eisen. Stoffe in diesem Sinne nennen wir Reinstoffe, wenn sie nur aus einer Sorte von Atomen, Kristallen oder Molekülen bestehen. Oder wir nennen sie Gemische, wenn sie aus mindestens zwei verschiedenen Reinstoffen bestehen.
Schriftgrößen-optimiert nach Peter Krimbacher, CC BY-SA 2.0 DE
Auch alle Lebewesen bestehen aus unzähligen Stoffen, aber im Gegensatz zu nicht lebender Materie tauschen Lebewesen in ihren aktiven Lebensphasen ständig die Stoffe aus, aus denen ihre Körper bestehen. Diesen ständigen Austausch nennt man Stoffwechsel.

Jeder Stoff hat eine einzigartige Kombination von Eigenschaften. Und aufgrund dieser Kombination von Eigenschaften kann man verschiedene Stoffe von einander trennen und jeden isolierten Reinstoff identifizieren. So kann man z.B. Zucker und Salz von einander unterscheiden und identifizieren, weil sie unterschiedlich schmecken. Dieser Test ist allerdings nur zu empfehlen, wenn man sicher weiß, dass es sich nur um Zucker oder Salz und keinen giftigen Stoff handeln kann. Eine weitere Möglichkeit der Unterscheidung kann auch zur Isolierung des Salzes aus einem Gemisch mit Zucker bietet die Tatsache, dass nur Zucker verbrennt.
Reines Wasser kann man daran erkennen, dass es auf Meereshöhe bei 0°C gefriert und bei 100°C verdampft. Andere Stoffe haben andere Schmelz- und Siedepunkte, an denen man sie erkennen kann.
Erhitzt man verschiedene Salze mit einer Flamme, dann verleiht jedes Salz der Flamme eine andere Farbe.
Die folgenden Beispiele zeigen, wie unterschiedliche Eigenschaften genutzt werden können, um vermischte Stoffe voneinander zu trennen:
| Destillation heißt eine Methode zur Trennung von Flüssigkeiten mit unterschiedlichen Siedepunkten. Das Flüssigkeitsgemisch wird auf eine Temperatur erhitzt, bei der die eine Flüssigkeit möglichst deutlich stärker verdunstet als die andere. Der Dampf steigt auf und wird langsam abgekühlt. Auch beim Abkühlen kann zur Trennung genutzt werden, dass die Kondensation der verschiedenen Flüssigkeiten bei unterschiedlichen Temperaturen erfolgt. So macht man es bei der Gewinnung von Gas, Benzin und Diesel aus Rohöl. Im folgenden Schema erfolgt allerdings die Kondensation nur mit einem einfachen Liebigkühler. Der reicht aus für die Herstellung von destiliertem Wasser, weil die in Leitungswasser enthaltenen Salz-Ionen gar nicht verdunsten. |
|
|
| anonym, Public domain |
| 1: Heizplatte, 2: Rundkolben, 3: Kolbenaufsatz/Destillationskolonne, 4: Thermometer, 5: Kondensator (Gegenstromkühler), 6: Kühlwasserzufuhr, 7: Kühlwasserauslass, 8: Rundkolben für das Destillat, 9: Vakuum-/Gaseinlass, 10: Verbindungsstück zur Destillatüberleitung, 11: Wärmeregler, 12: Regler der Rührgeschwindigkeit, 13: Magnetrührer, 14: Ölbad, Sandbad, oder Wasserbad, 15: Rührmagnet/Siedesteinchen, 16: Kühlendes Wasser-/Eisbad |
Andere Stoff-Eigenschaften helfen zwar nicht bei der Trennung von Stoffen, aber bei deren Identifizierung. Dazu gehören das Aussehen, der Geruch, der Geschmack, Leitfähigkeit, Wasserlöslichkeit (hydrophil oder hydrophob), Magnetismus und wie sich ein Stoff anfühlt.

| Kupfersulfat-Kristall |

|
| anonym, CC BY-SA 3.0 |
Wir haben in fester Form vorliegendes Kochsalz (NaCl) und Kupfersulfat (CuSO4) in Wasser gelöst. Salze bestehen aus Ionen. Das sind elektrisch positiv oder negativ geladene Atome. Salz-Kristalle sind fest und hart, weil sich elektrisch positiv oder negativ geladene Ionen gegenseitig stark anziehen. Trotzdem kann Wasser Kristalle auflösen, weil Wasser-Moleküle eine elektrisch positive und eine elektrisch negative Seite haben. Dadurch können sie alle Ionen binden und umhüllen. Erst wenn alle Wasser-Moleküle an Ionen gebunden sind, kann kein weiteres Salz aufgelöst werden. Man nennt das eine gesättigte Lösung und erkennt es daran, dass ungelöstes Salz auf dem Boden des Gefäßes liegt.
| Lösung eines Kochsalz-Kristalls in Wasser |
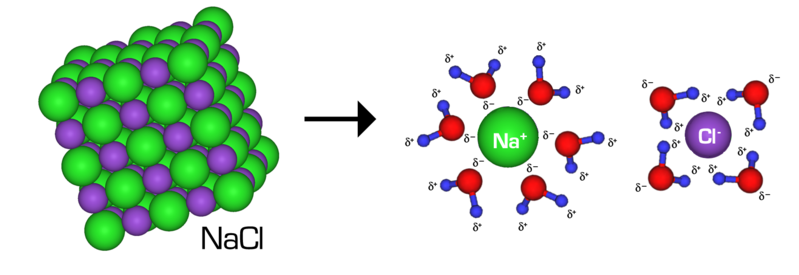
|
| Andrea Hazard, CC BY-SA 4.0 |
Während der Ferien ist das Wasser verdunstet. Dadurch gab es immer weniger Wasser-Moleküle für die Umhüllung der Ionen. Deshalb wurden immer mehr Ionen frei und zogen sich aufgrund gegensätzlicher Ladungen gegenseitig an. Dadurch wuchsen langsam Salz-Kristalle heran. Auf diese Weise haben wir die Salze vom Wasser getrennt.
Beim Verdunsten wechselte das Wasser vom flüssigen zum gasförmigen Aggregatzustand. Den festen Aggregatzustand des Wassers kennen wir als Schnee oder Eis.

| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| a1 | Nenne die drei in Atomkernen und Atomhüllen zu findenden Teilchenarten und ihre elektrischen Ladungen! |
| a2 | Erkläre, warum kleine massereiche Teilchen meistens ungehindert durch Atome hindurch fliegen können! |
| Hier geht es zu den Antworten. | |
Der griechische Philosoph Leukipp und sein Schüler Demokrit entwickelten schon vor fast zweieinhalb Tausend Jahren die Theorie, dass alle Materie aus kleinsten unteilbaren Teilchen bestehen müsse, zwischen denen sich nur leerer Raum befinde. Demokrit nannte diese unteilbaren Teilchen Atomos (deutsch: Atom). Endgültig bewiesen ist diese Theorie bis heute nicht, bisher sprechen aber viele naturwissenschaftliche Befunde dafür.
Auf der Grundlage wichtiger chemischer und mathematischer Vorarbeiten von Robert Boyle, Daniel Bernoulli, des Ehepaars Marie-Anne Pierrette und Antoine Laurent de Lavoisier und Jeremias Benjamin Richter nannte 1803 der englische Lehrer und Naturwissenschaftler John Dalton die von den Chemikern entdeckten kleinsten Teilchen der chemischen Elemente Atome, weil sie sich mit mechanischen und chemischen Mitteln nicht weiter zerlegen lassen.
Atome heißen sie bis heute, obwohl Ernest Rutherford vor gut 100 Jahren mit seinem berühmten Streuungsexperiment beweisen konnte, dass unsere sogenannten Atome keineswegs die unteilbaren kleinsten Teilchen sind, die Leukipp und Demokrit gemeint hatten.
Im sehr dichten und massereichen, positiv geladenen Atomkern befinden sich positiv geladene Protonen und ungeladene Neutronen. In der verglichen mit dem Atomkern gigantisch großen und fast leeren Atomhülle befinden sich die winzig kleinen, negativ geladenen Elektronen. Zusammen erreichen die Elektronen der Atomhülle maximal ein Zweitausendstel der Masse des Atomkerns. Und im Gegensatz zu den Protonen und Neutronen des Atomkerns scheinen die Elektronen tatsächlich unteilbar zu sein.
Atome sind nicht alle gleich, sondern es gibt sie in verschiedenen Größen und mit unterschiedlichen Eigenschaften. Man nennt die verschiedenen Atom-Sorten chemische Elemente. Das kleinste und leichteste chemische Element ist Wasserstoff, das zweitkleinste heißt Helium. In der Natur gibt es 80 unterschiedliche chemische Elemente, die stabil sind und nicht radioaktiv zerfallen. Zusätzlich wurden in der Natur 14 radioaktive Elemente gefunden, die mit die der Zeit von selbst zerfallen. Weitere 24 chemische Elemente zerfallen nach ihrer Entstehung im Labor oder in einer Supernova so schnell, dass ihre Existenz bisher nur in Laboratorien nachgewiesen werden konnte. Um die Chemie zu verstehen, muss man daher nur wenige Dutzend chemische Elemente wirklich gut kennen und wissen, was sie tun.
| Die Elektronenschalen der ersten 10 chemischen Elemente |
|---|
|
|
| Das Schema zeigt die Atomkerne und die Elektronenschalen der ersten 10 chemischen Elemente des Periodensystems nach Art des einfachen Atom-Modells von Niels Bohr. |
Das Atom-Modell von Niels Bohr sieht vor, dass die Elektronen den Atomkern umkreisen wie Planeten ihre Sonne. Dabei sollten die Elektronen keine elektromagnetischen Wellen abstrahlen, obwohl zumindest in unserer Welt der großen Dinge im Kreis fliegende elektrisch geladene Teilchen eigentlich genau das tun. Heute weiß man, dass die Elektronen nicht auf festen Bahnen um den Atomkern flitzen, weil man
Heute betrachten wir die Elektronenschalen als stark vereinfachendes Bild für die unterschiedlichen Energieniveaus, zwischen denen Elektronen hin und her hüpfen können. Auf ein höheres Energieniveau springen sie aber nur, wenn sie durch Energie-Zufuhr dazu anregt werden. Auf ein niedrigeres Energieniveau fallen sie unter Abstrahlung von Energie hinab, wenn es in einem Atom für ein Elektron einen freien Platz auf einem niedrigeren Energieniveau gibt.

| Aufgaben zur Erarbeitung der Kapitel: "Periodensystem der Elemente", Edelgase, Alkalimetalle, Erdalkalimetalle und Halogene. | |
|---|---|
| b1 | Definiere die beiden Begriffe Valenzschale und Valenzelektron! |
| b2 | Erkläre, warum die Valenzelektronen und die Valenzschale so wichtig sind! |
| b3 | Erkläre, warum die Atomdurchmesser der Elemente im Periodensystem von links nach rechts abnehmen! |
| b4 | Erkläre, warum die im Periodensystem untereinander stehenden Elemente sehr ähnliche Eigenschaften haben! |
| b5 | Erkläre, warum die ganz rechts im Periodensystem stehenden Elemente Edelgase sind, die keine Art von Bindung mit anderen Atomen oder Ionen eingehen! |
| Hier geht es zu den Antworten. | |
Valenzschale nennen Chemiker die äußerste mit Elektronen besetzte Schale in der Elektronenhülle eines Atoms.
Valenzelektron nennt man jedes Elektron in der äußersten Elektronenschale eines Atoms. Die Valenzelektronen sind von allen Elektronen eines Atoms am weitesten vom positiv geladenen Atomkern entfernt, werden daher von diesem am schwächsten angezogen und können diesem deshalb auch am leichtesten entrissen werden. Da sie den äußeren Rand jedes Atoms bilden, bestimmen die Valenzelektronen das chemische Verhalten eines Atoms.
Das Periodensystem der chemischen Elemente ordnet die Elemente nach der Zahl ihrer Protonen, Valenzelektronen und Eigenschaften so, dass chemische Elemente mit ähnlichen Eigenschaften untereinander stehen.
Jede Zeile (Periode) im Periodensystem steht für eine Elektronenschale, die ein Atom umgibt. Man sieht, dass die kleinsten chemischen Elemente Wasserstoff und Helium nur eine Elektronenschale besitzen, die beim Wasserstoff ein und beim Helium zwei Elektronen enthält. Mehr Elektronen passen in die erste Elektronenschale nicht hinein. In der zweiten Periode stehen die chemischen Elemente mit zwei Elektronenschalen. In sie passen 8 Elektronen und deshalb gibt es in der zweiten Periode des Periodensystems 8 chemische Elemente. Auch in der dritten Periode stehen acht chemische Elemente, weil auch die dritte Elektronenschale nur acht Elektronen aufnehmen kann. Die darunter folgenden Perioden enthalten mehr chemische Elemente (Nebengruppenelemente), weil es da unter der wieder nur 8 Elektronen fassenden Valenzschale noch eine Art Zwischenschale gibt, in die noch mehr Elektronen passen. Da wird es komplizierter, als wir es für die Biologie wissen müssen.
| Periodensystem der chemischen Elemente |
|---|
|
|
| Dr. Peter Cüppers, Public domain |
| Das Periodensystem ordnet die chemischen Elemente nach der Zahl ihrer Protonen, Valenzelektronen und Eigenschaften so, dass Elemente mit ähnlichen Eigenschaften untereinander stehen. |
Das folgende Periodensystem betont die Art der Orbitale, in denen die äußersten Elektronen eines chemischen Elementes stecken.
| Periodensystem der chemischen Elemente |
|---|
|
|
| Dr. Peter Cüppers, Public domain |
| Das Periodensystem ordnet die chemischen Elemente nach der Zahl ihrer Protonen, Valenzelektronen und Eigenschaften so, dass Elemente mit ähnlichen Eigenschaften untereinander stehen. |
Innerhalb einer Zeile (Periode) nehmen die Durchmesser der chemischen Elemente von links nach rechts ab, weil ungefähr gleich weit vom Atomkern entfernte Elektronen von immer mehr Protonen im Atomkern angezogen werden.
| Periodensystem der chemischen Elemente |
|---|
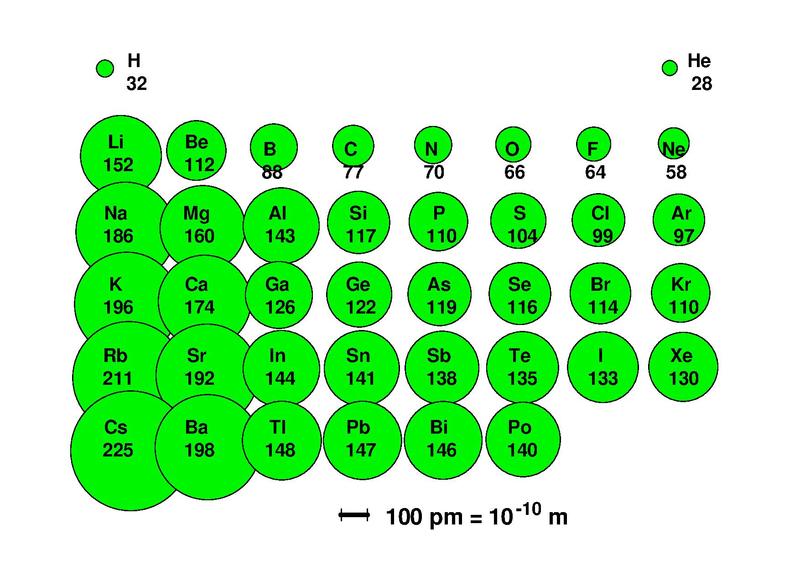
|
| Bleckneuhaus, CC BY-SA 3.0 |
| Das Periodensystem ordnet die chemischen Elemente nach der Zahl ihrer Protonen, Valenzelektronen und Eigenschaften so, dass chemische Elemente mit ähnlichen Eigenschaften untereinander stehen. |

Ganz rechts im Periodensystem stehen die Edelgase, die so heißen, weil sie so stabil sind (Man könnte auch sagen, sie sind mit sich zufrieden.), dass sie mit keinem anderen Atom chemisch reagieren. Die Ursache für diese Selbstgenügsamkeit ist offenbar eine volle äußere Elektronenschale (Valenzschale). Alle anderen chemischen Elemente scheinen unbedingt ebenfalls eine volle Valenzschale haben zu wollen. Zu den Edelgasen gehören Helium, Neon, Argon, Krypton, Xenon, das radioaktive Radon sowie das künstlich erzeugte, ebenfalls radioaktive Oganesson.

Ganz links in der 1. Hauptgruppe stehen untereinander die Alkalimetalle Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Caesium (Cs) und Francium (Fr). Sie alle geben besonders leicht ihr einziges Valenzelektron ab und werden zu einfach positiv geladenen Ionen.

In der 2. Hauptgruppe stehen untereinander die Erdalkalimetalle Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra). Sie alle geben besonders leicht ihre beiden Valenzelektronen ab und werden zu zweifach positiv geladenen Ionen.

Links neben den Edelgasen stehen in der 7. Hauptgruppe (hier unter der 17) die Halogene (Fluor, Chlor, Brom, Iod, das äußerst seltene radioaktive Astat und das 2010 erstmals künstlich erzeugte, sehr instabile Tenness). Die Halogene besitzen 7 Valenzelektronen und benötigen zum Erreichen der Edelgaskonfiguration nur noch ein weiteres Elektron. Darum nehmen die Halogene besonders leicht ein zusätzliches Elektron auf und halten alle ihre Elektronen besonders fest.

Atome und ihre Eigenschaften kann man nur verstehen, wenn man auch ihre Orbitale und Hybridorbitale kennt. Deshalb habe ich zu diesem Thema einen eigenen Lerntext Orbitale und Hybridorbitale verfasst. Um das Lesen interessanter und zielgerichteter zu machen, gibt es dazu auch ein Übungsmodul Orbitale und Hybridorbitale mit klausurartigen Aufgaben.
Wer danach fasziniert von der Chemie ist, mag vielleicht einen Blick auf meine Chemie-Seiten werfen.

| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle und zum Einüben der Unterscheidung zwischen zwei nur scheinbar gleicher Aufgaben | |
|---|---|
| c1 | Erkläre, warum Atome links im Periodensystem stehender Elemente nur Valenzelektronen abgeben! |
| c2 | Erkläre, warum nur Atome links im Periodensystem stehender Elemente Valenzelektronen abgeben! |
| c3 | Beschreibe den Unterschied zwischen Atomen und Ionen! |
| Hier geht es zu den Antworten. | |
Die Elektronen größerer Atome befinden sich auf verschiedenen Energieniveaus. Um es verständlicher zu machen, stellt man sich diese Energieniveaus oft als Elektronenschalen vor. Die Elektronen in den inneren Elektronenschalen sind aufgrund ihrer größeren Nähe zum positiv geladenen Atomkern viel fester an diesen gebunden als die Elektronen der äußersten Elektronenschale (Valenzschale). Man nennt die Elektronen der äußersten Elektronenschale Valenzelektronen und praktisch nur sie bestimmen die chemischen Eigenschaften eines Atoms. Eine der wichtigsten Ursachen für chemische Reaktionen ist das Bestreben der Atome, ihre Valenzschale entweder ganz voll oder ganz leer zu machen. Man nennt diesen Zustand die stabile Edelgaskonfiguration, weil die Edelgase volle Valenzschalen besitzen und derart stabil (edel) sind, dass sie praktisch gar nicht an chemischen Reaktionen teilnehmen. Atome mit nur wenigen Valenzelektronen neigen dazu, ihre Valenzelektronen abzugeben. Atome mit fast vollen Valenzschalen neigen dazu, Elektronen aufzunehmen. Dadurch erhalten Atome negative oder positive elektrische Ladungen und man nennt sie im elektrisch nicht neutralen Zustand Ionen.

| Aufgaben zur Erarbeitung dieses Kapitels | |
|---|---|
| d1 | Erkläre Schritt für Schritt, warum und wie es zur Bildung von Salz-Kristallen kommt! |
| d2 | Erkläre, was bei der Ionen-Bindung die Ionen zusammenhält! |
| d3 | Erkläre, warum sich Nichtmetalle nicht durch Ionenbindungen miteinander verbinden! |
| Hier geht es zu den Antworten. | |
Natrium ist ein Alkali-Metall, dessen Atome in der Valenzschale nur ein Elektron besitzen, welches sie sehr leicht abgeben. Chlor ist ein äußerst aggressives Gas, dessen Atomen für eine vollständig gefüllte äußerste Elektronenschale nur ein einziges Elektron fehlt. Treffen ein Natrium-Atom und ein Chlor-Atom aufeinander, dann gibt das Natrium-Atom dem Chlor-Atom sein Valenzelektron und es entstehen ein positiv geladenes Natrium-Ion sowie ein negativ geladenes Chlorid-Ion.
Gegensätzlich elektrisch geladene Teilchen ziehen sich an. Das gilt auch für Ionen und man nennt die starke chemische Bindung zwischen positiv und negativ geladenen Ionen eine Ionenbindung. Typisch für Ionenbindungen ist, dass sich sehr viele Ionen zu großen Kristallen verbinden. So entsteht durch die Ionenbindungen zwischen vielen Natrium- und Chlorid-Ionen ein Natriumchlorid-Kristall, den wir Kochsalz nennen.
| Ionenbindung bei Natriumchlorid |
|---|
| Roland Heynkes, CC BY-SA-4.0 |
| Kristallstruktur des Minerals Cotunnit = Blei(II)Chlorid oder PbCl2 |
|---|
 |
| anonym, CC BY-SA 3.0 |

| Aufgaben zur Erarbeitung dieses Kapitels | |
|---|---|
| e1 | Erkläre die metallische Bindung! |
| e2 | Erkläre mit der metallischen Bindung die besonderen Eigenschaften der Metalle! |
| Hier geht es zu den Antworten. | |
Wie üblich in den Naturwissenschaften ist die Sache in Wirklichkeit sehr viel komplizierter und letztlich unanschaulich. Aber wenn man kein Quantenphysiker ist und nicht über deren mathematische Fähigkeiten verfügt, dann macht man nichts verkehrt, wenn man sich die metallische Bindung in einem Stück Metall mit Hilfe eines sogenannten Elektronengases vorstellt. Selbstverständlich wollen Atome nichts, weil sie ja keine Gehirne haben. Aber es macht die Sache für uns Menschen anschaulicher, wenn wir uns vorstellen, die Atome wollten immer eine volle oder eine ganz leere äußerste Elektronenschale (Valenzschale) haben. Denn Atome reagieren so, als wollten sie das. Und wenn wir uns vorstellen, die Atome strebten das an, dann können wir zuverlässig vorhersagen, was passieren wird.
Stellen wir uns also vor, Lithium-Atome fänden keine Halogen-Atome als Reaktionspartner für die Bildung eines Salzes. Da wären nur noch viele andere Lithium-Atome, die alle ihre einsamen Elektronen auf der zweiten Elektronenschale loswerden wollen. Wenn die Temperatur nicht extrem hoch ist, dann geben Atome ihre Elektronen aber nicht einfach so ins Leere bzw. in ein Plasma ab. Normalerweise brauchen sie andere Atome, welche die Elektronen übernehmen. Aber in einem Metall liegen sehr viele Metall-Atome dicht nebeneinander und alle geben einfach ihre äußersten Elektronen (Valenzelektronen) in die Zwischenräume zwischen den Atomen ab. So übernehmen quasi alle Metall-Atome gemeinsam die überschüssigen Elektronen und die Elektronen können sich zwischen ihnen frei wie ein Gas (Elektronengas) bewegen. Diese Beweglichkeit ist der Grund dafür, dass in Metallen Strom fließen kann, nämlich ein Strom von negativ geladenen Elektronen.
Die metallische Bindung können wir uns nun so vorstellen, dass zwischen all den positiv geladenen Metall-Ionen negativ geladene Elektronen herum fliegen. Dabei ziehen sich die positiven Ladungen der Metall-Ionen und die negativen Ladungen der Elektronen gegenseitig an. Und so werden die positiv geladenen Metall-Ionen durch das zwischen ihnen fließende Elektronengas zusammen gehalten.
Die besondere metallische Bindung ist der Grund für die typisch metallischen Material-Eigenschaften. Das sind eine hohe und mit steigender Temperatur abnehmende elektrische Leitfähigkeit, eine hohe Wärmeleitfähigkeit, eine relativ leichte Verformbarkeit sowie metallischer Glanz.
| Metallgitter-Modell mit Lithium-Ionen |
|---|
|
|
| Das Schema zeigt die einfach positiv geladenen Lithium-Ionen, die in einem Stück Metall ein Gitter bilden. Darin sitzt jedes Lithium-Ion an seinem Platz, aber sie schwingen umso stärker um ihre Positionen herum, je höher die Temperatur des Metalls ist. |

| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| f1 | Beschreibe eine Atombindung! |
| f2 | Beschreibe ein Molekül! |
| f3 | Erkläre den Unterschied zwischen Ionenbindungen und Atombindungen im Hinblick auf die Bildung von komplexen Biomolekülen! |
| f4 | Erkläre Schritt für Schritt, warum die Unterschiedlichkeit der Elektronegativitäten von Sauerstoff und Wasserstoff letztlich dazu führt, dass Wasser bei Raumtemperatur flüssig ist! |
| Hier geht es zu den Antworten. | |
Die Ionenbindung ist typisch für chemische Bindungen zwischen Metallen und Nichtmetallen. Chemische Bindungen gibt es aber auch zwischen Nichtmetallen. Aufgrund ihrer großen Elektronegativität trennen sich Nichtmetall-Atome allerdings normalerweise nicht von ihren Elektronen. Um trotzdem chemische Bindungen einzugehen zu können, müssen sich deshalb zwei Nichtmetall-Atome ihre Valenzelektronen teilen. Das kann etwas kompliziert sein, denn häufig erfordert es die Bildung sogenannter Hybridorbitale. Besonders an Chemie Interessierte können die Hybridorbitale im Lerntext Orbitale und Hybridorbitale kennenlernen. In stark vereinfachter Form kann man Atombindungen aber auch ohne dieses Wissen verstehen.
Eine Atombindung ist ein Elektronenpaar, welches zwei Atome miteinander verbindet, weil es mit seiner negativen Ladung zwischen zwei positiv geladenen Atomkernen liegt. Meistens steuert dazu jedes der beiden Atome ein Valenzelektron bei. Es können aber auch beide Elektronen eines bindenden Elektronenpaars vom selben Atom stammen.
|
Nur für besonders Interessierte:
Solch ein beiden Atomen gehörendes gemeinsames Elektronenpaar (Bindungselektronenpaar) entsteht quasi als Misch- oder Fusions-Orbital durch die Überlappung zweier Valenzorbitale. Meistens steuert dazu jedes der beiden Atome ein Valenzorbital bei, das mit einem einsamen Valenzelektron gefüllt ist. Nicht selten verbindet sich aber auch ein mit zwei Valenzelektronen gefülltes Valenzorbital des einen Atoms mit einem leeren Valenzorbital des anderen Atoms. |
Moleküle sind chemische Verbindungen aus mindestens zwei Atomen über wenigstens eine (kovalente) Elektronenpaarbindung. Die folgende Darstellung soll das am besonders einfachen Beispiel zweier Wasserstoff-Atome (H) zeigen, die sich auf diese Weise zu einem Wasserstoff-Molekül (H2) verbinden.
| Atombindung am Beispiel des Wasserstoffs |
|---|
| Roland Heynkes, CC BY-SA-4.0 |
| Mit meiner Zeichnung versuche ich anschaulich zu machen, wie sich zwei H-Atome ihre beiden Elektronen teilen. Die positiv geladenen Atomkerne werden aneinander gebunden, weil sie beide durch die zwischen ihnen konzentrierte negative elektrische Ladung angezogen werden. |
| Eine Atombindung verbindet zwei Atome miteinander, indem zwei positiv geladene Atomkerne von der zwischen ihnen liegenden konzentrierten negativen elektrischen Ladung des Bindungselektronenpaars angezogen werden. |
Die meisten Atome verbinden sich mit anderen Atomen zu Metallen, Salzen oder Molekülen. Während Metalle und Salze beliebig viele Atome enthalten und beliebige Formen annehmen können, sind in Molekülen immer ganz bestimmte Atome in immer gleicher Anordnung miteinander verbunden. Ionenbindungen führen nur zu einfach strukturierten Kristallen ohne klar definierte Grenzen. Atombindungen hingegen ermöglichen hochkomplexe und eindeutig strukturierte Moleküle mit genau festgelegten Formen. Das ist sehr wichtig, weil die Eigenschaften eines Moleküls von seiner Struktur abhängen. Hätte beispielsweise das Wasser-Molekül nicht seine gewinkelte Form, dann gäbe es auf der Erde weder flüssiges Wasser noch Lebewesen.
Die folgende Zeichnung zeigt, wie aus einem Sauerstoff- und zwei Wasserstoffatomen ein Wasser-Molekül entsteht, indem sich das Sauerstoff-Atom zwei seiner Valenzelektronen mit zwei Wasserstoffatomen teilt. Dabei entstehen zwei bindende Elektronenpaare, deren negative elektrische Ladungen die positiv geladenen Wasserstoff-Atomkerne und die Protonen im Atomkern des Sauerstoff-Atoms anziehen. So entstehen zwei Atombindungen in einem Wasser-Molekül. Dabei werden allerdings die Bindungselektronenpaare stärker von den 8 Protonen des Sauerstoff-Atoms angezogen als von nur einem Proton in einem Wasserstoffatom. Deshalb befinden sich die Bindungselektronenpaare nicht genau in der Mitte zwischen dem Sauerstoff-Atomkern und je einem Wasserstoff-Atomkern. Die negative Ladung der Bindungselektronenpaare befindet sich näher am Sauerstoff-Atom. Darum ist das Sauerstoff-Atom etwas negativer und die Wasserstoffatome sind etwas positiver geladen als die elektrisch neutralen Atome. In der Zeichnung bedeutet dies, dass ein Wasser-Molekül oben leicht negativ und unten leicht positiv geladen ist.
| Atombindung am Beispiel des Wasser-Moleküls |
|---|
| Mit meiner Zeichnung versuche ich anschaulich zu machen, wie sich zwei H-Atome ihre beiden Elektronen teilen. Die positiv geladenen Atomkerne werden aneinander gebunden, weil sie beide durch die zwischen ihnen konzentrierte negative elektrische Ladung angezogen werden. |
Das macht ein Wasser-Molekül vergleichbar mit einem Stabmagneten, dessen Enden einem magnetischen Nord- und einem Südpol entsprechen. Und wie sich Stabmagneten gegenseitig anziehen, so ziehen sich auch Wasser-Moleküle gegenseitig an. Sie verbinden sich sogar über sogenannte Wasserstoffbrückenbindungen miteinander. Das zeigt folgende Zeichnung.
| Wasserstoffbrückenbindungen zwischen Wasser-Molekülen |
|---|
| anonym, Public domain |

|
Dieses Kapitel ist nur für besonders an organischer Chemie oder Molekularbiologe Interessierte. Denn leider gehören die Orbitale heute nicht mehr zum Kernlehrplan für Gymnasien. Ich halte das für einen schweren Fehler, denn wer die Orbitale nicht kennt und versteht, kann die Chemie des Kohlenstoffs und damit die organischer Chemie nicht wirklich verstehen. |
| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| g1 | Sieh Dir das Schema des Ethen-Moleküls an und erkläre den Vorteil einer Umwandlung von jeweils einem s- und zwei p-Orbitalen in drei sp2-Hybridorbitale für die Festigkeit der Sigma-Bindung zwischen den C-Atomen! |
| g2 | Sieh Dir das Schema des Ethen-Moleküls an und erkläre, warum die pi-Bindung schwächer ist als die Sigma-Bindung! |
| Hier geht es zu den Antworten. | |
Wasserstoff-Atome sind ein Grenzfall zwischen zwischen den Metallen und Nichtmetallen. Bei allen echten Nichtmetallen gibt es keine Valenzelektronen, die einsam in ihrer Valenzschale sind. Sonst wären es keine Nichtmetalle, sondern Metalle. Aber Atombindungen (Bindungselektronenpaare) werden von Valenzelektronen gebildet, die allein in ihren Valenzorbitalen sind. In jedes Orbital passen zwei Elektronen und das Atom erreicht einen stabileren Zustand (Edelgaskonfiguration), wenn seine Orbitale alle doppelt besetzt sind.
Das folgende Schema des Ethen-Moleküls zeigt grün die s-Orbitale der Wasserstoffatome, rot jeweils ein p-Orbital der Kohlenstoff-Atome sowie blau deren jeweils 3 sp2-Hybridorbitale, die alle in einer Ebene liegen und 120°-Winkel bilden. Außerdem zeigt das Schema des Ethen-Moleküls, wie die s-, p- und sp2-Hybridorbitale zu Bindungselektronenpaaren verschmelzen und auf diese Weise Atombindungen bilden.
| Schema des Ethen-Moleküls |
|---|
| Mit meiner Zeichnung versuche ich den Unterschied zwischen der (roten) pi-Bindung (π) zwischen den beiden C-Atomen und den (blauen) Sigma-Bindungen (σ) zwischen allen Ethen-Atomen deutlich zu machen. Die π-Bindung wird gebildet aus zwei p-Orbitalen. Die σ-Bindung zwischen den beiden C-Atomen wird gebildet von zwei überlappenden sp2-Hybridorbitalen. Die σ-Bindungen zwischen den C-Atomen und den Wasserstoffatomen (H) werden gebildet von jeweils einem sp2-Hybridorbital, das mit einem 1s-Orbital überlappt. |
Doppelbindungen wie die oben gezeigte bestehen aus einer σ-Bindung plus einer pi-Bindung und erlauben keine Rotation.

Wenn sich Atome miteinander verbinden, nennt man das eine chemische Reaktion. Viele chemische Reaktionen beginnen allerdings nicht spontan (von selbst). Um sie zu starten, bedarf es einer Aktivierungsenergie oder eines Katalysators. So muss man beispielsweise Papier erst erhitzen, damit es mit Sauerstoff zu Kohlenstoffdioxid und Wasser reagiert. Einmal gestartet, produziert sie soviel Energie, dass diese chemische Reaktion von selbst weiterläuft, bis kein Papier oder kein Sauerstoff mehr übrig ist. Auch ein Gemisch aus Wasserstoff und Sauerstoff explodiert nicht einfach von allein. Erst ein heißer Funke oder der Katalysator Platin bringt das Gemisch zur Explosion. Katalysatoren ersetzen die Aktivierungsenergie und starten chemische Reaktionen auch bei niedrigen Temperaturen. Deshalb werden in Lebewesen die meisten chemischen Reaktionen von Katalysatoren gestartet. Und weil die Lebewesen ihre Katalysatoren selbst herstellen, nennt man sie Biokatalysatoren. Ein anderer Name für einen Biokatalysator ist Enzym. Nur mit Hilfe der Enzyme können wir die unzähligen Biomoleküle aufbauen, aus denen unsere Körper bestehen. Einige besonders wichtige Sorten großer Biomoleküle sollte jeder gebildete Mensch kennen.

| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| h1 | Mit nur einem Elektron können Wasserstoffatome nur eine Atombindung aufbauen. Nenne die Zahl der Wasserstoffatome, die ein Kohlenstoff-Atom binden kann! |
| h2 | Erkläre die Bedeutung der verschiedenen Hybridisierungsmöglichkeiten des Kohlenstoff-Atoms für die Vielfältigkeit der Biomoleküle! |
| h3 | Nenne die Unterschiede zwischen Einfach- und Doppelbindungen! |
| h4 | Stell Dir ein bereits über eine Doppelbindung mit einem anderen C-Atom verbundenes Kohlenstoff-Atom vor! (Vielleicht hilft Dir eine Skizze.) Beschreibe die Anordnung und nenne die Anzahl der Wasserstoffatome, die das erwähnte Kohlenstoff-Atom dann noch binden kann! |
| h5 | Skizziere ein Molekül, in dem zwei C-Atome über eine Dreifachbindung miteinander verbunden sind und das zusätzlich noch Wasserstoffatome enthält! |
| h6 | Beschreibe das einfache Prinzip, nach welchem Methan (CH4) einen Tetraeder, Formaldehyd (CH2O) ein ebenes Dreieck und Kohlenstoffdioxid (CO2) eine gerade Linie bilden! |
| h7 | Sieh Dir im World Wide Web die Seiten von PubChem und der Protein Data Base an! |
| Hier geht es zu den Antworten. | |
Besonders wichtig ist die Atombindung in der Chemie des Kohlenstoffs, der sogenannten organischen Chemie. Das Kohlenstoff-Atom besitzt nämlich vier "einsame" Valenzelektronen. Wann immer möglich, bildet das Kohlenstoff-Atom damit vier Atombindungen mit bis zu vier anderen Atomen. Es kann sich aber auch zunehmend kürzer und fester durch Doppelbindungen oder Dreifachbindungen mit einem anderen Atom verbinden.
Entscheidend sind aber nicht nur die variable Anzahl und Unterschiedlichkeit der Atombindungen pro Kohlenstoff-Atom. Zur großen Flexibilität und Vielfältigkeit der Möglichkeiten der Kohlenstoff-Chemie trägt auch bei, dass C-Atome
Besonders oft sind Kohlenstoff-Atome mit Atomen der chemischen Elemente Kohlenstoff, Wasserstoff, Sauerstoff, Stickstoff, Schwefel und Phosphor verbunden. Doppelbindungen bilden Kohlenstoff-Atome hauptsächlich mit Sauerstoff, Stickstoff und anderen Kohlenstoff-Atomen. Um die Strukturformeln der Biomoleküle zu verstehen, muss man kaum mehr wissen. Und die Geometrie (räumlichen Form) eines Biomoleküls versteht man mit dem im Lerntext Orbitale und Hybridorbitale vermittelten Wissen um die Orbitale und Hybridorbitale. Wer das gar nicht so genau verstehen möchte, kann sich auch einfach folgendes Prinzip merken: Kohlenstoff-Atome richten ihre Atombindungen möglichst so aus, dass ihre 2-4 Partner-Atome so weit wie möglich von einander entfernt sind. Mit nur zwei Partner-Atomen bildet ein Kohlenstoff-Atom eine Gerade. Mit drei Partner-Atomen bildet ein Kohlenstoff-Atom ein ungefähr gleichseitiges Dreieck und mit vier Partner-Atomen bildet ein Kohlenstoff-Atom eine Pyramide mit dreieckigen Flächen (Tetraeder genannt).
Weil das räumliche Zeichnen nicht ganz einfach ist, zeichnet man die Strukturformeln der Biomoleküle aber meistens vereinfacht als nur zweidimensionale Projektionen. Glücklicherweise ist das Zeichnen längst nicht mehr die einzige Möglichkeit der Darstellung von Molekülen. Man kann heute die räumlichen Koordinaten vieler Moleküle Dank kostenloser Datenbanken wie PubChem oder Protein Data Base aus dem Internet auf den eigenen Rechner laden oder im Internet anzeigen lassen. Wurde in PubChem eine Struktur gefunden und auf dem Monitor angezeigt, dann klickt man rechts oben auf das Tetraeder-förmige Symbol für: "Launch Pc3D viewer application with the conformer". Leider wird dieses Symbol nicht bei jedem Molekül angezeigt, denn längst nicht für jedes Molekül der Datenbank existieren die Koordinaten (Conformer). Mit: "Download Pc3D viewer application" lädt man das kostenlose Programm auf den eigenen Rechner, wo man es installieren und zur Darstellung von Molekülen nutzen kann. Mit: "View the conformer with Pc3D viewer application" lädt man die Koordinaten auf den eigenen Rechner.). Mit dem Pc3D Molecule Viewer lassen sich Moleküle anzeigen, wobei viele Parameter eingestellt werden und die Strukturen aus allen denkbaren Blickwinkeln angezeigt werden können. Ist man mit der Darstellung zufrieden, dann kann man sie als Bild exportieren und weiterverarbeiten.

Informationen zu den Biomolekülen findet man im Lerntext Biomoleküle.