
Lerntext Antibiotika und Phagen-Therapie
Roland Heynkes 16.11.2025, CC BY-SA-4.0 DE
If you cannot read German-language texts, you could try a translation into your native language with DeepL.
Verbunden mit meinem Glossar soll dieser Selbstlern-Hypertext helfen, sich selbst im eigenen Tempo zu erarbeiten, was Lernende am Ende der Unterrichtsreihe zum Thema Gesundheit im Gedächtnis behalten sollten.
|
Der selbständigen Erarbeitung dieses Selbstlern-Hypertextes dient das Übungsmodul Gesundheit mit klausurähnlichen Aufgaben. |
| Die Entdeckung der Antibiotika |
|---|
| Antibiotika-Vorteile |
| Antibiotika-Probleme |
| Phagen vermehren sich auf Kosten von Bakterien. |
| Die Entdecker der Phagen |
| Phagen-Therapie als Alternative zu Antibiotika |

Antibiotikum heißt ein Medikament oder Wirkstoff, wenn es/er Mikroorganismen tötet (z.B.: bakterizide Antibiotika) oder zumindest ihre Vermehrung verhindert (z.B.: bakteriostatische Antibiotika). Ärzte verwenden den Begriff meistens in einem engeren Sinne als Medikament gegen Bakterien. Antibiotika werden von Pilzen produziert, aber auch von Bakterien und durch viele, wenn nicht alle andere Lebensformen (z.B.: die Phytoalexine und Defensine aus Zellen aller Tiere und höheren Pflanzen sowie ganz besonders effektiv die Antibiotika aus Schwämmen). Sie können auch chemisch synthetisiert oder modifiziert werden.
Der Entdeckung des vor rund 5000 Jahren in den Alpen ermordeten Ötzi verdanken wir die Erkenntnis, dass Menschen schon seit Jahrtausenden Pilze zur Bekämpfung von Entzündungen, Krebszellen und Infektionskrankheiten nutzen, die durch Bakterien und sogar Viren verursacht werden. Vor allem in der traditionellen ostasiatischen Medizin werden auch heute noch häufig getrocknete Heilpilze und ihre Zubereitungen als Arzneimittel verwendet [Pharma Wiki]. Laut der ZDF-Dokumentation: "Die geheime Macht der Pilze - Wie sie uns helfen aber auch gefährden" stammt heute die Hälfte der 20 wertvollsten Medikamente aus Pilzen.
Schon 1893 isolierte und kristallisierte Bartolomeo Gosio die Mycophenolsäure aus einem Schimmelpilz der Gattung Penicillium. Gosio beobachtete und veröffentlichte, dass er damit das Wachstum des Milzbrand-Erregers behindern konnte. Seine Veröffentlichung blieb aber lange unbeachtet. [BAAO]
Auch schon 1897 reichte der französische Militärarzt Ernest Duchesne seine Doktorarbeit mit der durch systematische Experimente mit Meerschweinchen und Bakterien-Kulturen bestätigten Beobachtung ein, dass bestimmte Schimmelpilze über antibiotische Eigenschaften verfügen. Er selbst lernte das im Grunde von arabischen Stallknechten, die absichtlich das Wachstum von Schimmelpilzen auf Sätteln förderten, weil dadurch Scheuerwunden schneller abheilten. Seine Doktorarbeit war die erste wissenschaftliche Arbeit zur Erforschung der medizinischen Nutzbarkeit von Antibiotika produzierenden Schimmelpilzen, aber das Institut Pasteur verweigerte dieser Doktorarbeit des damals erst 23-jährigen Mediziners die Anerkennung. Er starb an Tuberkulose, bevor die französische Akademie für Medizin erst aufgrund des Nobelpreises für Alexander Flemming begriff, wie unrecht man dem jungen Franzosen getan und wie sehr man durch die eigene Ignoranz den medizinischen Fortschritt auf Kosten unzähliger Menschenleben verzögert hatte. [BAAP]
Das dritte von Menschen erforschte Antibiotikum war Arsphenamin. Es wurde durch den Chemiker Alfred Bertheim im Labor von Paul Ehrlich synthetisiert sowie 1909 von Paul Ehrlich und Hata Sahachiro positiv getestet [BAAQ]. Es wurde von Hoechst produziert und kam als wirksames und relativ ungefährliches Medikament gegen die damals weit verbreiteten Geschlechtskrankheit Syphilis unter dem Namen Salvarsan 1910 als erstes Antibiotikum in den Handel.
Das vierte von Menschen entdeckte und das dritte auf den Markt gebrachte Antibiotikum war Penicillin. Alexander Flemming hatte seine antibiotische Wirksamkeit zwar schon 1928 in seinem Londoner Labor entdeckt und auch schon seine Ungefährlichkeit für menschliche Zellen nachgewiesen, aber es gelang ihm nicht, Penicillin in ausreichender Menge und Reinheit zu isolieren [BAAR]. Erst 1938 untersuchten Howard Florey, Ernst Boris Chain und Norman George Heatley systematisch alle von Mikroorganismen gebildeten Stoffe mit veröffentlichter antibakterieller Wirkung und Ernst Boris Chain stieß dabei auch auf die 10 Jahre alte Veröffentlichung von Alexander Flemming. Vor allem Norman George Heatley isolierte Penicillin aus Schimmelpilz-Kulturen, während die Kollegen seine therapeutische Wirkung zunächst an Mäusen und 1941 auch an einer ersten Patientin untersuchten. Nachdem sie keine Unterstützung britischer Pharma-Unternehmen erhalten hatten, gingen Howard Florey und Ernst Boris Chain in die nicht von deutschen Raketen bedrohten USA, wo das Militär ein für den Ausgang des zweiten Weltkriegs sehr wichtiges Programm mit Tausenden Mitarbeitern für die Zucht und Kultivierung des Pilzes sowie die Testung und Produktion von Penicillin organisierte. 1945 erhielten Alexander Flemming, Ernst Boris Chain und Howard Florey für ihre Entdeckung den Nobelpreis, während man Norman George Heatley überging. [Wikipedia und Dokumentation: "Die geheime Macht der Pilze - Wie sie uns helfen aber auch gefährden"]
Das fünfte von Menschen entdeckte und das zweite chemisch synthetisierte sowie auf den Markt gebrachte Antibiotikum war 1935 ein Sulfonamid. Der durch den Zusammenschluss von unter anderem von Hoechst, der Bayer-AG, der Badischen Anilin- und Sodafabrik (BASF) und AGFA entstandene deutsche Chemiekonzern I.G. Farben gehörte zu den Herstellern synthetischer Azofarbstoffe aus dem Abfallprodukt Steinkohlenteer. Nach dem Vorbild von Paul Ehrlichs Salvarsan unternahm I.G. Farben ein Forschungsprogramm zur systematischen Identifizierung antibakteriell wirksamer chemischer Verbindung aus der Gruppe der Farbstoffe. In dessen Verlauf synthetisierten Fritz Mietzsch und Josef Klarer 1932 ein Sulfonamid und Gerhard Domagk veröffentlichte im Februar 1935 den Nachweis, dass es in Versuchstieren zu einem antibakteriell wirksamen Stoff verarbeitet wird. I.G. Farben verkaufte es unter dem Markennamen Prontosil und Gerhard Domagk wurde 1939 der Nobelpreis verliehen. Der Wirksamkeitsnachweis in Mäusen erfolgte aber wohl schon 1931 im I.G. Farben-Labor in Wuppertal (Bayer) [BAAS].
Das sechste von Menschen entdeckte Antibiotikum war das 1939 von René Jules Dubos aus menschlichen Tränen isolierte und chemisch sowie klinisch analysierte Tyrothricin, das aus den Polypeptiden Tyrocidin und Gramicidin besteht und auch schon Jahre vor Penicillin kommerziell verfügbar war.
Alexander Flemming war also nicht der erste Entdecker eines Antibiotikums und das Pilze Antibiotika produzieren können. Die besondere Leistung von Alexander Flemming bestand darin, über die Ursache einer Beobachtung nachgedacht zu haben, die zuvor er selber und viele andere Forscher schon häufig gemacht hatten. Die Antwort auf die Frage zu finden, war einfach. Aber sich über eine Beobachtung überhaupt zu wundern und die Frage nach der Ursache zu stellen, das ist die ebenso entscheidende wie schwierige Leistung, die zu großen Fortschritten in Medizin und Naturwissenschaften führt, falls die Entdecker die richtigen Menschen von der Bedeutung ihrer Entdeckungen überzeugen können.
Fast alle Bakterien-Kulturen verschimmeln nach einer Weile und genau wie unzählige andere Forscher hatte Alexander Flemming das sicher schon unzählige Male gesehen. Genau wie fast alle Kollegen hatte er aber vorher nicht genau hingesehen, nicht darauf geachtet oder zumindest nicht darüber nachgedacht. Aber irgendwann machte er die bewusste Beobachtung und verstand ihre Bedeutung. Ihm fiel auf, dass sich rund um einen Pilz ein Saum (ein Streifen oder Grenzbereich) gebildet hatte, auf dessen Fläche keine Bakterien bzw. Bakterien-Kolonien wuchsen. Er schloss daraus, dass höchstwahrscheinlich der Pilz einen Stoff produzierte und an das ihn umgebende Nährmedium abgab, der die Bakterien tötete oder zumindest an Wachstum und/oder Vermehrung hinderte. Tatsächlich töten Penicilline sich teilende Bakterien, indem sie deren Bildung neuer Zellwände sabotieren.
Im Nachhinein wundert man sich, dass es nicht viel früher und öfter zu dieser bewussten Beobachtung (dem ersten Schritt der Naturwissenschaftlichen Methode) kam. Aber es existiert offensichtlich eine sehr hohe Hürde, die uns Menschen meistens daran hindert, genau hinzusehen und über Beobachtungen nachzudenken. Wir würden wohl auch ständig zu spät kommen und unsere alltäglichen Aufgaben vergessen, wenn wir über alles nachdächten, was wir sehen. Genau diese Aufmerksamkeit, Nachdenklichkeit und Neugier unterscheidet jedoch große Forscher (und Autisten) von Menschen ohne besondere wissenschaftliche Begabung.

Einige Antibiotika hemmen den Aufbau bakterieller Zellwände. Andere blockieren den bakteriellen Stoffwechsel. Antibiotika retten dadurch sehr viele Leben von Menschen und Haustieren.
Antibiotika wirken meistens schnell und das ist wichtig, weil Krankheiten wie die Sepsis ohne Antibiotika sehr schnell zu Tod führen können.
Antibiotika töten ein breites oder sehr breites Spektrum unterschiedlicher Bakterien-Stämme. Auch das kann Leben retten, weil man oft nicht schnell genug ermitteln kann, welches Bakterium für eine Krankheit verantwortlich ist.

Antibiotika können unwirksam sein und wie jedes wirksame Medikament haben sie auch Nebenwirkungen. Im Umgang mit Antibiotika gibt es allerdings schon lange einige gefährliche Fehlentwicklungen:

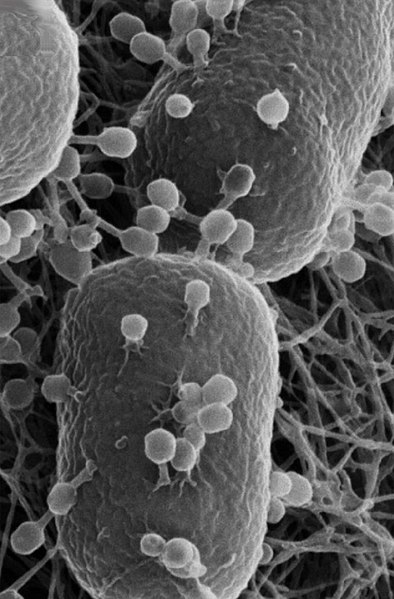
T4-Phagen auf einem Escherichia coli-Bakterium  |
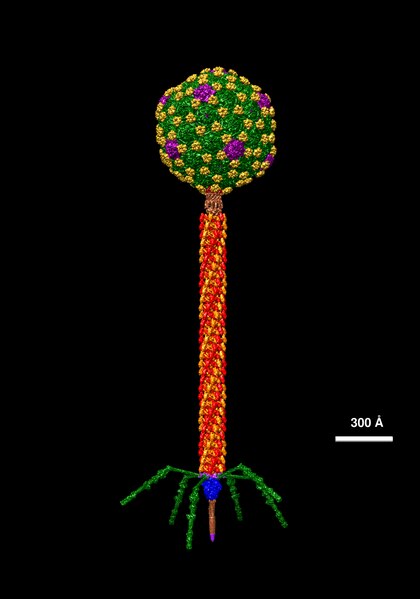
Der Escherichia-Phage Lambda in höchster Auflösung  |
|---|---|
 |
 |
| Miika Leppänen, CC BY-SA 4.0 | Dr. Victor Padilla-Sanchez, CC BY-SA 4.0 |
Bakteriophagen (kurz: Phagen) sind Viren, die sich sehr spezifisch nur in bestimmten Bakterien vermehren. Verschiedene Phagen-Stämmen besitzen sehr unterschiedlich geformte Hüllen, die meistens aus Proteinen und manchmal aus Lipiden bestehen. Die Hülle umschließt den Bakteriophagen-Bauplan, der aus RNA oder DNA besteht. Letztere kann einzel- oder doppelsträngig sein. Man unterscheidet außerdem aufgrund unterschiedlicher Vermehrungs-Strategien Lytische- (virulente Phagen) und Lysogene Phagen (Temperente Phagen). Lytische- oder virulente Phagen wie der bekannte T4-Phage vermehren sich immer durch den Lytischen Zyklus. Lysogene oder Temperente Phagen wie der Phage Lambda vermehren sich im Gegensatz zu Lytischen Viren erstmal nicht durch den Lytischen Zyklus, sondern zusammen mit dem bakteriellen Genom vor jeder Zellteilung. Dieses Temperenz genannte Phänomen gibt es nicht nur bei Phagen, sondern auch bei anderen Viren.
| Schema der Vermehrung lytischer und Lysogener Bakteriophagen |
|---|
|
|
Links veranschaulichen die Stadien 1-6 den lytischen Weg der Phagen Vermehrung.:
|
Der sich genau wie die Phagen T4 und Lambda im Bakterium Escherichia coli vermehrende Bakteriophage namens M13 ist weder ein lytischer noch ein lysogener Phage. M13 vermehrt sich im Inneren des Bakteriums wie ein Lytischer Phage, verlässt aber seine Wirtszelle ohne sie zu töten. Meiner Meinung nach hat sich M13 vom Krankheitserreger zum Parasit evolutionär weiter entwickelt.

Im Jahr 1896 beschrieb als erster der britische Wissenschaftler Ernest Hanbury Hankin die Vernichtung pathogener Bakterien durch etwas, dass filtrierbar (also kleiner als Bakterien) und hitzeempfindlich ist und nur da im Flusswasser zu finden war, wo es auch die Bakterien gab. Weil aber die bakterizide Wirkung beim Erhitzen in einem offenen Gefäß schneller nachließ als in einem verschlossenen, dachte Hankin an eine flüchtige Substanz. [BABJ]
Weil man für jedes pathogene Bakterium viele harmlose verwandte Stämme gefunden hatte, vermutete Frederick William Twort, dass dies auch bei Viren so sein könnte. Er sah nur das Problem, die Existenz nicht pathogener Viren nachzuweisen, weil man sie lichtmikroskopisch nicht sehen kann und das Elektronenmikroskop noch nicht erfunden war. Seltsamerweise richtete er seinen Fokus aber nicht auf die Suche nach nichtmenschlichen Wirtszellen, sondern auf verschiedene Quellen und Kulturmedien. Nicht ganz überraschend wurden so nur einige sporenbildende Bakterien isoliert. Er versuchte auch, Kaninchen und Meerschweinchen mit gefilterten Proben zu infizieren. Aber so hätte man keine nicht pathogenen Viren finden können, sondern nur Viren, die statt Menschen eben andere Wirte brauchen. Tatsächlich gibt es ja auch gar keine intakten Viren, die ohne Wirtszellen auskommen oder permanent lysogen bleiben. Das war aber damals noch nicht bekannt und wurde erst durch Felix d'Herelle so klar erkannt. [BAAF]
Verschiedene Quellen nennen ihn Félix Haerens, Hubert Augustin Félix Haerens, Félix Haerens d'Herelle oder Félix Hubert d'Hérelle.
Wikitree verortet die Geburt von Hubert Augustin Félix Haerens d'Herelle am 25. April 1873 in der Rue de Berry 47 im 8. Arrondissement von Paris als Sohn der 24-jährigen Augustine Josèphe Haerens und eines angeblich unbekannten Vaters. Seine Mutter soll ihn durch eine am 7. Mai 1879 im Rathaus des 8. Arrondissements von Paris ausgestellte Urkunde anerkannt haben [BABR].

In einer kritischen Zusammenfassung habe ich 2019 erklärt und kommentiert, was ich in der französischen Fernseh-Dokumentation: "Mysteriöse Bakterienkiller - Mit Viren aus der Antibiotika-Krise" zum Thema Bakteriophagentherapie oder einfach Phagentherapie gesehen habe [DAY]. Leider nur noch bei YouTube kann man: "Mysteriöse Bakterienkiller - Mit Viren aus der Antibiotika-Krise" sehen. Obwohl inzwischen auch in westlichen Staaten viel zu diesem Thema geforscht wird, sind wir auch Mitte 2025 politisch nicht viel weiter. Darum übernehme ich hier die Informationen von damals als eine von vielen sich ergänzenden und teilweise widersprechenden Quellen. Damit die Lesbarkeit dieses Textes nicht zu sehr unter den vielen Quellenangaben leidet, verweise ich nur mit Vierbuchstabencodes auf einen eigenen Text für jede Quelle.
Auf eigene Kosten kann man inzwischen auch in Deutschland eine Phagentherapie bekommen, wenn man gut informiert ist. Informationen dazu findet man bei phage-germany.de. Meiner unmaßgeblichen Meinung als wütender Beitragszahler nach zeigt das, dass unseren zuständigen Politikern und Behörden ihre eigene Bequemlichkeit wichtiger ist als die Gesundheit und das Leben von Patienten, denen kein Antibiotikum mehr helfen kann. Aber ich bin nicht der Einzige, der die Nichtzulassung der Phagentherapie angesichts von europaweit jährlich mehr als 400.000 Infektionen und 25.000 Todesfällen durch multiresistente Bakterien unmoralisch und inakzeptabel findet [BABB].
Bakteriophagen (oder einfach Phagen) sind Viren, die sich nur in Bakterien vermehren und deshalb völlig ungefährlich für unsere Zellen sind. Jedes Virus kann sich nur in Zellen vermehren, an die es nach dem Schlüssel-Schloss-Prinzip andocken kann. Nur wenn ein Oberflächen-Protein des Virus genau zu einem Oberflächen-Protein der Zelle passt, kann das Virus seinen Bauplan in die Zelle bringen. Hinsichtlich dieser Oberflächen-Proteine unterscheiden sich auch die verschiedenen Bakterien-Spezies. Deshalb wirken Phagen sehr viel spezifischer als Antibiotika. Denn Antibiotika sind Moleküle, die Bakterien relativ unspezifisch töten. Es lassen sich relativ leicht Bakteriophagen finden, die nur einen bestimmten Krankheitserreger töten, nicht aber all die anderen Bakterien-Spezies, die ein Mensch braucht, um gesund zu bleiben [DAY,BAAZ].
Ein weiterer großer Vorteil der Phagen ist, dass sie mutieren und sich dadurch im Gegensatz zu Antibiotika schnell anpassen können, wenn ein Bakterium resistent wird. Und setzt man zwei verschiedene Bakteriophagenstämme mit unterschiedlichen "Schlüsseln" gleichzeitig ein, dann haben Bakterien praktisch keine Chance mehr, sich anzupassen. Diese von Anderen erst beim schwierigen Kampf gegen den besonders oft mutierenden AIDS-Erreger wieder entdeckte Idee hatte schon der geniale Phagen-Entdecker Félix d'Herelle [DAY,BAAV].
Wie bei den Antibiotika wurde auch die Bakterien tötende Eigenschaft der Bakteriophagen anscheinend bereits Ende des 19. Jahrhundert entdeckt, aber Ernest Hanbury Hankin wusste nicht, wer oder was die Bakterien in indischen Flüssen tötete [BAAL]. Die Dokumentation schreibt Félix d'Herelle die Entdeckung der Bakteriophagen zu und nennt dafür das Jahr 1914 [DAY]. Die Wikipedia nennt als ersten Entdecker der Bakteriophagen den britischen Bakteriologen Frederick Twort, der seine Entdeckung 1915 in "The Lancet" veröffentlichte [BAAF,BAAM,BAAZ]. Unabhängig von dieser lange ignorierten Publikation fielen auch Félix d'Herelle bei der Zucht von Bakterien auf Nährmedien Löcher im Bakterienrasen auf [BAAD,BAAT].
1915 [BABE] bzw. laut der Dokumentation bereits 1914 [DAY] untersuchte Félix d'Herelle Fälle bakterieller Dysenterie (Bakterienruhr) im Krankenhaus des Institut Pasteur. Dabei entdeckte er die klaren Punkte in den Bakterienrasen von Bakterien-Kulturen, mit denen man die Krankheitserreger aus dem Stuhl der Patienten untersuchte [BABE]. Das Insitut Pasteur hingegen schreibt, Félix d'Herelle habe die klaren Punkte 1915 während einer Bekämpfung von Heuschrecken in Tunesien in den Bakterienrasen von Coccobazillen-Kulturen entdeckt. Jedenfalls erst im September 1917 präsentierte Félix d'Herelle der "Académie des sciences de Paris" einen Bericht mit dem Titel: "Sur un microbe invisible antagoniste des bacilles dysentériques" [BAAD,BAAH,BAAZ,BABE]. Dabei führte er den Namen: "Bakteriophage" ein [BABE].
Die Löcher im Bakterienrasen entstanden, weil dort die Bakterien durch Bakteriophagen getötet wurden. Diese sind allerdings so klein, dass sie mit Lichtmikroskopen nicht entdeckt werden konnten. Laut Wikipedia bestätigte Helmut Ruska erst 1939 mit seinem Elektronenmikroskop die Existenz von Bakteriophagen [BAAW,BAAX].
Anfang 1919 gab es in Frankreich eine von Salmonellen verursachte Epidemie von Geflügeltyphus (Fowl Typhoid) [DAY,BABE]. Für Félix d'Herelle war das eine Gelegenheit zur Überprüfung seiner Hypothese, dass Patienten die Krankheit überwinden, wenn in ihnen Phagen die Krankheitserreger töten und dass genesende Patienten durch die Verbreitung ihrer Phagen eine Epidemie zu stoppen [BABE]. Er isolierte Bakteriophagen aus Hühnerkot und bekämpfte damit erfolgreich Hühner-Typhus [DAY]. Félix d'Herelle erkannte das Potential der Bakteriophagen für die Therapie bakterieller Infektionskrankheiten [DAY,BAAZ,BABE]. Die erste Phagentherapie für Menschen erfolgte 1921 im Hôpital des Enfants-Malades (Paris) [BABE]. Mit der Phagentherapie erholten sich die jungen Patienten schnell von Dysenterie (Shiga) [BABE]. Kollegen hielten nicht viel vom Autodidakten Félix d'Herelle und seiner Phagen-Theorie und kritisierten ihn auch wegen seiner Anwendung bei Menschen [DAY]. Aber bevor er die ersten kranken Kinder damit behandelte, trank er zum Beweis der Ungefährlichkeit selbst die Phagen-Lösung [DAY. Von da an produzierte das "le laboratoire du bactériophage" in Paris Phagen-Präparationen gegen verbreitete Infektionskrankheiten [BABE]. Schon bald nach ihrer Entdeckung wurden trinkbare Phagen-Suspensionen zur Behandlung zahlreicher bakterieller Infektionskrankheiten benutzt [DAY,BABA,BAAX,BABE] und weltweit vermarktet [BABE]. Aber 1945 begann in westlichen Ländern das goldene Zeitalter der Antibiotika und die Phagentherapie wurde aufgegeben [BABE]. Im Ostblock wurde sie weiterhin erfolgreich eingesetzt [BABE].
Schon im August des selben Jahres behandelte er den ersten Menschen mit einer Phagentherapie. Dieser war an der Bakterienruhr (Dysenterie) erkrankt [BAAD,BAAH]. Genau wie zuvor Frederick Twort wusste auch Félix d'Herelle damals noch nicht genau, was er entdeckt hatte. Aber er ging schon von Organismen aus, die sich irgendwie von Bakterien ernähren. Andere bezweifelten das und kritisierten ihn auch wegen seiner Anwendung bei Menschen. Aber bevor er die ersten kranken Kinder damit behandelte, trank er zum Beweis der Ungefährlichkeit selbst die Phagen-Lösung. Nachdem er in Paris die ersten schwer an Bakterienruhr erkrankten Kinder erfolgreich behandelt hatte, rettete Félix d'Herelle mit seiner Phagentherapie 1925 Pest-Patienten in Ägypten sowie 1926 Cholera-Patienten in Indien. Im ägyptischen Alexandria reduzierten Ärzte mittels Phagentherapie ab 1928 die Bakterienruhr-Mortalität von 25% 5% [BABC].
Die Bakteriophagentherapie boomte vor allem beim Militär während des zweiten Weltkriegs, bis ein gewaltiges Projekt in den USA zur ersten massenhaften Produktion von Penicillin führte und die Bakteriophage scheinbar überflüssig machte. Denn Penicillin konnte in großen Mengen produziert und problemlos transportiert werden, war chemisch stabil und wirkte bei vielen verschiedenen Bakterienstämmen. Es hindert Bakterien daran, ihre Zellwände zu bilden und lässt sie platzen, sobald sie sich zu vermehren versuchen. Penicillin kann von jedem leicht angewendet werden, während man für die Phagentherapie ein Labor und das Wissen erfahrener Experten brauchte, um für jeden Patienten passende Bakteriophagen zu suchen. Darum verdrängte Penicillin die Phagentherapie. Seitdem wurde die Bakteriophagentherapie im sogenannten Westen nicht mehr angewendet. Doch inzwischen haben wir mit den Antibiotika das zunehmende Problem der multiresistenten pathogenen Bakterien. Problem der multiresistenten Bakterien. Das macht die Phagentherapie auch für westliche Ärzte wieder interessant.
Pathogene Bakterien und die uns davor schützenden Bakteriophagen können aus Patienten oder aus Abwasser isoliert werden. So lassen sich mit der Zeit Phagen-Banken mit mindestens einer Bakteriophagen-Spezies gegen fast jeden bakteriellen Krankheitserreger aufbauen. Die Bundesregierung und viele andere Regierungen machen sich aber nicht die Mühe, in der EU den rechtlichen Rahmen für die Anwendung der Phagentherapie zu schaffen. Dabei verzichten die selben Regierungen nahezu völlig auf die Qualitätskontrolle bei Implantaten und Heilpraktikern. In der Dokumentation erklärt die Geschäftsführerin der nationalen französischen Agentur für die Sicherheit von Arzneimitteln die Untätigkeit damit, dass intensive Diskussionen nur dazu geführt haben, die Phagen als Arzneimittel einzustufen, obwohl die für Arzneimittel geltenden Zulassungsbestimmungen für Phagen völlig ungeeignet sind. Da drängt sich die Frage auf, wie ignorant Wissenschaftler und Politiker und Behördenmitarbeiter eigentlich sein dürfen.
Immerhin erlauben die belgische und die französische Regierung im Gegensatz zur Bundesregierung bei austherapierten Patienten das Experimentieren mit der Phagentherapie in ausgewählten Kliniken. Aber selbst da behauptete einer der behandelnden französischen Ärzte in einem Interview, es gebe noch zu wenig Erfahrung mit der Phagentherapie [Dokumentation: Mysteriöse Bakterienkiller - Mit Viren aus der Antibiotika-Krise]. Was für eine Arroganz und Ignoranz angesicht der jahrzehntelangen Erfolge und Erfahrungen, die Wissenschaftler und Ärzte damit in Osteuropa gemacht haben! Wenn wir unsere Leben retten oder eine Amputation vermeiden wollen, dann fliegen wir daher besser gleich zu den wahren Experten nach Tiflis in Georgien, wo man seit Jahrzehnten über große Erfahrung mit der Phagentherapie und eine umfangreiche Bakteriophagen-Sammlung verfügt. Denn bis unsere westeuropäischen Ärzte das Rad neu erfunden haben, wird es wohl noch dauern.
Mit Bakteriophagen lassen sich nicht nur menschliche Patienten heilen, sondern auch unsere Tiere. Das wäre auch für die menschliche Gesundheit extrem wichtig, weil wir dadurch auf Antibiotika selbst in der Massentierhaltung verzichten könnten. Denn heute züchtet die Massentierhaltung durch den massenhaften Einsatz von Antibiotika in Tierställen immer mehr Antibiotika-resistente Bakterienstämme, die das Leben von Millionen Menschen bedrohen und in Zukunft gigantische Kosten im Gesundheitssektor und in der Wirtschaft verursachen werden.
Übrigens könnte man nach dem Vorbild der Bakteriophagen auch Viren gentechnisch herstellen und züchten, die ganz spezifisch nur bestimmte Krebszellen töten.