








Die Chemie wird von den Atomkernen nur über die Elektronegativität und fast gar nicht von den inneren Elektronenschalen bestimmt. Die chemischen Reaktionen finden hauptsächlich in der äußersten Elektronenschale (Valenzschalen) bzw. in deren Valenzorbitalen statt. Was Orbitale und Valenzorbitale sind, soll dieser Lerntext erklären. Durch Überlagerung verbinden Valenzorbitale als sogenannte kovalente Bindungen Atome zu Molekülen. Dabei haben die chemischen Elemente höherer Perioden deutlich mehr und unterschiedlichere Valenzorbitale. Oft benutzen Atome aber nicht einfach die vorhandenen Valenzorbitale in ihren jeweiligen normalen Formen. Vielmehr bilden sie sogenannte Hybridorbitale, die sich besonders gut für die Ausbildung kovalenter Bindungen eignen.
Dieser Hypertext soll möglichst verständlich erklären, was man zum Verständnis der Biologie über Orbitale und Hybridorbitale wissen sollte. Zu diesem Selbstlern-Hypertext habe ich ein Übungsmodul Hybridorbitale mit klausurähnlichen Aufgaben erstellt.
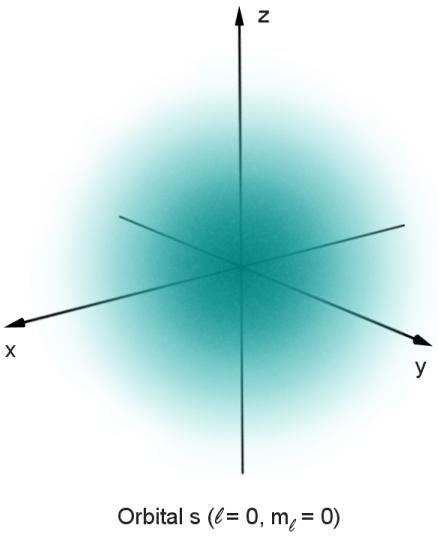
Was sind überhaupt Orbitale
|
|---|
Orbital nennen Chemiker den Aufenthaltswahrscheinlichkeitsraum eines Elektrons oder zweier Elektronen. Man kann sich Orbitale auch als die Formen stehender Wellen vorstellen, wenn man an die wellenartigen Eigenschaften von Elektronen denkt. Es gibt Orbitale mit unterschiedlichen Formen und Energieniveaus und die Ausrichtung der Valenzorbitale um ein Atom ist entscheidend für dessen Eigenschaften und chemische Bindungen. Die Idee der Orbitale ist eine stimmigere Verfeinerung des Modells der Elektronenschalen.
die unterschiedlichen Orbitale
|
|---|
Die innerste Elektronenschale jedes Atoms besteht aus nur einem Orbital. Dabei handelt es sich um ein kugelförmiges s-Orbital, welches mit zwei Elektronen besetzt werden kann. Lediglich Wasserstoffatome enthalten in ihrem 1s-Orbital nur ein einsames Elektron. Helium als zweitkleinstes chemisches Element besitzt zwei Elektronen, die sich beide in diesem s-Orbital befinden bzw. deren Aufenthaltswahrscheinlichkeitsraum durch dieses s-Orbital beschrieben wird.
Die Atome des drittkleinsten chemischen Elementes Lithium (des kleinsten Elementes der zweiten Periode) besitzen 3 Elektronen. Das s-Orbital reicht dafür nicht aus. Das dritte Elektron muss auf dem nächsthöheren Energieniveau, der zweiten Elektronenschale untergebracht werden. Es befindet sich allein als einsames Elektron im 2s-Orbital, also dem s-Orbital der zweiten Elektronenschale. Der Durchmesser des 2s-Orbitals ist viel größer als der Durchmesser des 1s-Orbitals. Deshalb kann man sich vorstellen, dass dieses Valenzelektron im Durchschnitt weiter vom Atomkern entfernt ist, daher weniger stark von ihm angezogen und entsprechend leichter abgespalten wird.
Auch das vierte Elektron des viertkleinsten chemischen Elementes Beryllium befindet sich im 2s-Orbital.
Atome der Elemente ab Lithium, also ab der zweiten Periode besitzen mindestens noch eine zweite Elektronenschale. Und ab der zweiten Elektronenschale enthalten alle höheren Elektronenschalen außer einem s-Orbital noch drei hantelförmige p-Orbitale.| Schema der 5 Orbitale der beiden innersten Elektronenschalen |
|---|
 |
| Sven X, public domain |
| Die 1 und die 2 stehen für die jeweilige Elektronenschale bzw. ein grobes Energieniveau. s-Orbitale sind kugelförmig, p-Orbitale hantelförmig. In der oberen Bildhälfte deuten die Punkte an, dass Orbitale nicht scharf begrenzt sind. |
die Hundsche Regel
|
|---|
Die Hundsche Regel (der größten Multiplizität) besagt, daß energetisch identische Orbitale zunächst alle mit nur einem Elektron besetzt und erst danach mit einem zweiten Elektron gefüllt werden.
In scheinbarem Widerspruch zur Hundschen Regel befinden sich die beiden Valenzelektronen der chemischen Elemente der zweiten Hauptgruppe nicht in zwei separaten Orbitalen, sondern beide gemeinsam in einem einzigen, kugelförmigen Aufenthaltswahrscheinlichkeitsraum namnes s-Orbital. Dabei besitzen alle chemischen Elemente außer Wasserstoff und Helium mindestens 4 Valenzorbitale, in welchen wenigstens 4 ungepaarte Elektronen Platz fänden. Die Aufenthaltswahrscheinlichkeitsräume (Orbitale) der Valenzelektronen sind aber nicht alle gleich. Die drei frei gebliebenen p-Orbitale sind energetisch ungünstiger.
Ladungsverteilung innerhalb von Orbitalen
|
|---|
| Schema der Elektronendichte im 1s-Orbital |
|---|
 |
| R.J.Hall, CC BY-SA 3.0 |
| Das Schema zeigt die homogene Verteilung der negativen Ladung in einem 1s-Orbital. |
In einem Orbital nimmt die Wahrscheinlichkeit des Aufenthaltes eines Elektrons nach außen hin langsam ab. Aber auch innerhalb eines kugelförmigen 2s-Orbitals ist die Aufenthaltswahrscheinlichkeit der maximal zwei Elektronen weder gleichmäßig verteilt, noch nimmt sie kontinuierlich zu. Vielmehr gibt es im Inneren dieser Kugelwolke eine Schicht minimaler Elektronendichte bzw. Aufenthaltswahrscheinlichkeit. Mit der Vorstellung eines teilchenartigen Elektrons ist dies kaum vereinbar. Eher erinnert dieses Orbital an eine stehende, kugelförmige Welle. Die Darstellung zeigt, daß die beiden Bäuche dieser Welle allerdings sehr unterschiedlich groß sind.
| Schema der Elektronendichte im 2s-Orbital |
|---|
| Roland Heynkes, CC BY-SA-4.0 |
| Das Schema ist technisch ausbaufähig, zeigt aber ungefähr die inhomogene Verteilung der negativen Ladung in einem 2s-Orbital. |
Noch deutlicher als bei den s-Orbitalen wird der Wellencharakter bei den hantelförmigen p-Orbitalen. Hier sieht man schon äußerlich, dass das Orbital in zwei Hälften geteilt ist. Wären Elektronen einfach nur Teilchen, wären geteilte Aufenthaltswahrscheinlichkeitsräume extrem unwahrscheinlich.
Tabelle der Orbitalmodelle
|
|---|
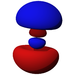
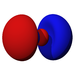
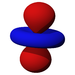
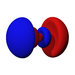
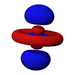
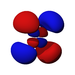
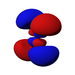
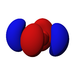
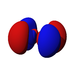
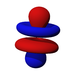
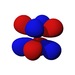
Ab der dritten Periode besitzen die chemischen Elemente auch fünf d-Orbitale und ab der vierten Periode kommen noch sieben f-Orbitale hinzu. Die folgende Tabelle zeigt die ganze Vielfalt der Orbitale. Klickt man auf ein Orbital, dann wird es stark verrgrößert dargestellt.
| Orbitale | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| s | pz | px | py | dz2 | dxz | dyz | dxy | dx2-y2 | fz3 | fxz2 | fyz2 | fxyz | fz(x2-y2) | fx(x2-3y2) | fy(3x2-y2) | |
| 1 |  |
|||||||||||||||
| 2 |  |
 |
 |
 |
||||||||||||
| 3 |  |
 |
 |
 |
 |
 |
 |
 |
 |
|||||||
| 4 |  |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| 5 |  |
 |
 |
 |
 |
 |
 |
 |
 |
|||||||
| 6 |  |
 |
 |
 |
||||||||||||
| 7 |  |
|||||||||||||||
| anonym, CC BY-SA 3.0 | ||||||||||||||||
seltsame Befüllung der Orbitale aufgrund überlappender Elektronenschalen
|
|---|
Die einem Atom zur Verfügung stehenden Orbitale werden so mit Elektronen gefüllt, dass jedes Elektron in das jeweils energieärmste Orbital kommt, in dem noch ein Platz frei ist. Stehen mehrere energetisch gleichwertige Orbitale mit freien Plätzen zur Verfügung, dann werden sie zunächst mit einzelnen Elektronen besetzt. Sind auf dem höchsten Energieniveau alle gleichwertigen Orbitale einfach besetzt, dann kommen die nächsten Elektronen in die bereits mit jeweils einem Elektron besetzten Orbitale, bis alle energetisch gleichwertigen Orbitale doppelt besetzt sind. Im Grunde verhalten sich also die Elektronen wie einander fremde Reisende in einem Bus, die sich auch erst neben andere Fahrgäste setzen, wenn alle Sitzbänke einfach besetzt sind.
Betrachtet man nun die im Periodensystem aufgelisteten chemischen Elemente, dann würde man erwarten, dass eine Elektronenschale nach der anderen aufgefüllt wird. Das ist jedoch nicht der Fall, weil sich die Elektronenschalen hinsichtlich der Energieniveaus ihrer Orbitale überlappen. Die folgende Tabelle zeigt, wie die Ordnung der Elektronenschalen nach oben hin immer stärker durcheinander gerät.
| Anordnung der s-Orbitale nach ihren Energieniveaus | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 7Px | 7Py | 7Pz | |||||||||||||
| 6dz2 | 6dxz | 6dyz | 6dxy | 6dx2-y2 | |||||||||||
| 5fz3 | 5fxz2 | 5fyz2 | 5fxyz | 5fz(x2-y2) | 5fx(x2-3y2) | 5fy(3x2-y2) | |||||||||
| 7s | |||||||||||||||
| 6pz | 6x | 6py | |||||||||||||
| 5dz2 | 5dxz | 5dyz | 5dxy | 5dx2-y2 | |||||||||||
| 4fz3 | 4fxz2 | 4fyz2 | 4fxyz | 4fz(x2-y2) | 4fx(x2-3y2) | 4fy(3x2-y2) | |||||||||
| 6s | |||||||||||||||
| 5pz | 5px | 5py | |||||||||||||
| 4dz2 | 4dxz | 4dyz | 4dxy | 4dx2-y2 | |||||||||||
| 5s | |||||||||||||||
| 4pz | 4px | 4py | |||||||||||||
| 3dz2 | 3dxz | 3dyz | 3dxy | 3dx2-y2 | |||||||||||
| 4s | |||||||||||||||
| 3pz | 3px | 3py | |||||||||||||
| 3s | |||||||||||||||
| 2pz | 2px | 2py | |||||||||||||
| 2s | |||||||||||||||
| 1s | |||||||||||||||
| Roland Heynkes, CC BY-SA-4.0 | |||||||||||||||
Das folgende Schema ordnet die Orbitale nun wieder so an, wie man es nach dem zu einfachen Schalenmodell erwarten würde. Die Schlangenlinie verbindet die Orbitale in der Reihenfolge ihrer Energieniveaus bzw. ihrer Befüllung.
| Madelung-Schema der s-Orbital-Befüllung |
|---|
| Andrzej Okuniewski, CC BY-SA 4.0 |
| Das Schema zeigt die Reihenfolge der Energieniveaus und der daraus folgenden Reihenfolge, in der die Orbitale mit Elektronen befüllt werden. K, L, M, N, O, P und Q sind die traditionellen Namen der Elektronenschalen. |
Glücklicherweise entspricht die Befüllung der Orbitale bei den in Biomolekülen vorkommenden leichten Elementen noch ganz der ursprünglichen Erwartung.
| Vergleich des einfachen Schalen- und eines etwas verfeinerten Orbital-Modells |
|---|
| Das Schema zeigt die Überlappung der Energieniveaus von Orbitalen verschiedener Elektronenschalen. |
Promotion von Elektronen
|
|---|
Das tragende chemische Element in den Biomolekülen ist der Kohlenstoff. Kohlenstoff-Atome haben 6 Elektronen, die wie oben beschrieben auf die energieärmsten Orbitale verteilt sind. 2 Elektronen füllen das 1s-Orbital und ebenfalls 2 Elektronen befinden sich im 2s-Orbital. Die restlichen beiden Elektronen besetzen je ein 2p-Orbital. In der (nach dem zweifachen Nobelpreisträger Linus Pauling) sogenannten Pauling-Schreibweise stellt man die Situation folgendermaßen dar:
| Das Schema zeigt links die theoretische Verteilung der Elektronen auf ein Kohlenstoff-Atom im allerdings normalerweise nicht vorkommenden Grundzustand. Mittels Energieaufnahme führt die sogenannte Promotion zum angeregten Zustand, der aber auch nur ein theoretischer Übergangszustand ist. Dieser angeregte Übergangszustand geht sofort über in eine Hybridisierung von 2-4 Orbitalen (sp, sp2, sp3). |
Hybridorbitale
|
|---|
Obwohl die Bildung von Hybridorbitalen eine außerordentlich unanschauliche Sache ist und mancher Chemielehrer sie genau wie die üblichen Chemiebücher in ihrem Hang zur übertriebenen didaktischen Reduktion so lange wie nur irgend möglich unbesprochen lassen, sind sie doch sehr wichtig für das Verständnis der räumlichen Anordnung der Atome in vielen Molekülen. Kennt man nicht wenigstens die einfachsten Hybridorbitale, dann kann man vieles in der Schulchemie nur ohne Sinn und Verstand auswendig lernen, weil man es eben nicht verstehen kann. Meines Erachtens lernt man aber sehr viel leichter und mit mehr Spaß an der Sache, wenn man das Gelernte auch versteht. Deshalb versuche ich eine möglichst einfache Darstellung der wichtigsten Hybridorbitale und ihrer Bedeutung.
Genau wie die s-Orbitale sind die p-Orbitale und auch die oben gezeigten d-Orbitale trotz ihrer teilweise sonderbaren Formen symmetrisch um den Atomkern herum verteilt. Gerade deshalb eignen sie sich aber auch nicht besonders gut für die Bildung von Molekülen durch kovalente Bindungen. Ideal für solche Atombindungen wären Valenzorbitale, die sich möglichst eng um die Verbindungsachse konzentriert dem Reaktionspartner weit entgegen strecken. Tatsächlich sind Atome fähig, solche Valenzorbitale bei Bedarf zu bilden. Ich glaube nicht, daß man wirklich anschaulich begreifen kann, wie sie das machen und was sie dazu anregt. Es lässt sich allerdings berechnen und experimentell nachweisen, daß sie es wirklich tun. Irgendwie bilden Atome durch eine Art mathematische Mischung mehrerer normaler Valenzorbitale neue und ganz anders geformte Hybridorbitale, die sich perfekt für die Bildung kovalenter Bindungen eignen.
Unverzichtbar insbesondere für das Verständnis der organischen Chemie ist die Kenntnis der Hybridorbitale, welche durch eine Mischung von s- und p-Valenzorbitalen zustande kommen. Da es auf jeder Elektronenschale ein s-Orbital und drei p-Orbitale gibt, existieren drei mögliche Kombinationsmöglichkeiten.
| die wichtigsten Hybridorbitale des Kohlenstoff-Atoms | ||
|---|---|---|
| Sven, CC BY-SA 3.0 | ||
| Sp-Hybridorbitale | Sp2-Hybridorbitale | Sp3-Hybridorbitale |
Als Beispiele für diese drei räumlichen Anordnungen kann man sich auf einer eigenen Seite die räumlichen Strukturen der einfachen Kohlenstoff-Verbindungen Kohlenstoffdioxid (CO2), Formamid (CH2O) und Methan (CH4) in dreidimensionalen Modellen mittels JSmol von allen Seiten ansehen und selber mit der Maus drehen.
Von Bedeutung sind diese drei Varianten deshalb, weil sie drei grundlegend verschiedene Molekülgeometrien zur Folge haben, denen man besonders in der organischen Chemie ständig begegnet. Vor allem, aber nicht nur in der Biochemie, werden die Eigenschaften und Funktionen eines Moleküls wesentlich durch seine räumliche Form bestimmt. Deshalb kann man zwar in der Chemie extrem vereinfachend mit Summenformeln oder Strukturformeln ohne Räumlichkeit arbeiten, aber wirklich verstehen kann man Moleküle ohne Kenntnis ihrer dreidimensionalen Struktur nicht.
Kommentare und Kritik von Fachleuten, Lernenden und deren Eltern sind jederzeit willkommen.
Roland Heynkes, CC BY-SA-4.0