












| Aufgaben zur Erarbeitung des Lerntextes bzw. zur Lernkontrolle | |
|---|---|
| 1 | Beschreibe und skizziere, was man bei der Diffusion eines Farbtropfens in Wasser mit bloßen Augen beobachten kann! |
| 2 | Nenne die Energieform, welche die Diffusion antreibt! Und erkläre, wie diese Energieform die Diffusion antreibt! |
| 3 | Beschreibe und skizziere, welche von außen sichtbaren Effekte bei der im Lerntext gezeichneten Osmose-Versuchsanordnung zu erwarten sind! |
| 4 | Erkläre drei mögliche Ursachen der Osmose! |
| 5 | Erkläre, warum der Effekt der Osmose im Verlauf des in der Animation beginnenden Experiments immer langsamer wird und schließlich zum Stillstand kommt! |
| 6 | Erkläre mit jeweils einem Satz, warum von Süßwasser umgebene Zellen automatisch a) durch Osmose Wasser aufnehmen und es b) dabei reinigen! |
| Hier geht es zu den Antworten. | |
Eine Grundlage der Osmose ist die Diffusion. Diffusion nennt man die zufällige und dadurch relativ gleichmäßige Verteilung von Atomen, Ionen oder Molekülen in Gasen oder Flüssigkeiten aufgrund unzähliger zufälliger Zusammenstöße zwischen den ständig in Bewegung befindlichen Teilchen.
im Experiment sichtbare Effekte einer Diffusion
|
|---|
Plaziert man sehr vorsichtig einen kleinen Tropfen Farbe in einem mit ganz ruhigem Wasser gefüllten Glas, dann sollte man mit bloßem Auge beobachten können, dass der Tropfen langsam größer und blasser wird. Die folgende Animation zeigt das mit allerdings zu langsamem Verblassen und zu scharf dargestellter Ausbreitungsfront. Warum es passiert, kann man nicht sehen.
Soweit die Theorie, aber sollte man so einer Animation einfach glauben? Nein, eigentlich nicht. Naturwissenschaftlichem Denken entspräche es, die Sache selbst experimentell zu überprüfen. Dass dies gar nicht so einfach ist, zeigt mein kleines Zeitraffer-Video von einem spontan mit Haushaltsmitteln durchgeführten Experiment. Im Wasser gab es noch Strömungen, welche die Farbe gerichtet bewegten. Für eine bessere Plazierung eines Tropfens fehlte mir eine Spritze mit dünner Nadel. Immerhin sieht man aber deutlich, dass die Diffusion links in wärmerem Wasser erheblich schneller verlief.
Diffusion  |
|---|
| Roland Heynkes, CC BY-NC-SA 4.0 |
| Meine Zeitraffer-Aufnahme zeigt 10 Minuten in 25 Sekunden. |
Es wäre vielleicht eine nette Aufgabe für einen naturwissenschaftlichen Schülerwettbewerb, die Farbe durch einen Schlauch von hinten durch eine winzige Bohrung in einer Platte fließen zu lassen, die mit nur geringem Abstand hinter der Frontscheibe eines mittels Heizung und Umwälzpumpe gleichmäßig temperierbaren Aquariums steht. So ließen sich Versuchsreihen bei verschiedenen Temperaturen durchführen und auswerten.
| Schema zur Veranschaulichung der Diffusion in Wasser |
|---|
|
|
| Dieses Schema vereinigt drei Darstellungsmöglichkeiten der Diffusion. |
Erklärung der Diffusion
|
|---|
Die Ursache der Zusammenstöße ist die ständige Bewegung der Teilchen. Und die Ursache der Bewegung ist die Wärmeenergie. Wärmeenergie (thermische Energie) ist die Energie, die in der ungeordneten Bewegung von Licht- oder Materie-Teilchen steckt. Bei Temperaturen oberhalb des absoluten Nullpunkts (0 Kelvin oder -273,15°C) bewegen sich die Teilchen (Atome, Ionen und Moleküle), denn vereinfacht ausgedrückt ist die Temperatur ein Maß für die durchschnittliche kinetische Energie, mit der sich die Teilchen in Gasen, Flüssigkeiten oder Körpern ungerichtet hin und her bewegen. Wenn sich Teilchen in Luft oder Wasser bewegen, dann fliegen sie mit konstanter Geschwindigkeit geradeaus, bis sie mit einem anderen Teilchen zusammenstoßen. Dann prallen beide Teilchen voneinander ab und ändern dabei Geschwindigkeit und Richtung. Die Summe der kinetischen Energien beider Teilchen bleibt dabei gleich, sofern auch ihre chemischen Energien unverändert bleiben (weil es zu keiner chemischen Reaktion kommt).
Die Zufälligkeit der Zusammenstöße und der dadurch bedingten Richtungsänderungen führt dazu, dass sich die Moleküle eines Farbtropfens in einer Flüssigkeit oder in einem Gas mit der Zeit immer gleichmäßiger verteilen.
Da die Diffusion nicht leicht zu verstehen ist, beginnen wir mit einem besonders einfachen Fall. Dazu stellen wir uns vor, in einem ansonsten leeren Raum (Vakuum) befänden sich zahlreiche Luft-Moleküle dicht gedrängt an einem Ort. Weil sie ständig in Bewegung sind, stoßen die Teilchen gegeneinander und prallen voneinander ab. Dabei hängt die Wahrscheinlichkeit eines Zusammenpralls von der Flugrichtung ab. Fliegt ein Teilchen in Richtung höherer Teilchen-Konzentrationen, dann kommt es schneller bzw. nach kürzerer Wegstrecke zum nächsten Zusammenstoß. Fliegen Teilchen in Richtung niedrigerer Teilchen-Konzentrationen, dann können sie im Durchschnitt größere Strecken ungestört fliegen. Deshalb bewegen sich die Teilchen insgesamt eher voneinander weg, obwohl sie ständig ihre Flugrichtungen ändern.
Zusätzlich ist es natürlich so, dass sich weniger Teilchen von einem Ort mit niedrigerer Teilchendichte in Richtung höherer Teilchendichte bewegen können, einfach weil es am Ort geringerer Teilchendichte weniger Teilchen gibt, die sich zu einem anderen Ort begeben könnten.
| Schema zur Veranschaulichung der Diffusion in Wasser |
|---|
|
|
| Die blauen Kreise stellen kleine Wasser-Moleküle dar, die roten große Farb-Moleküle. |
In der Zeichnung ist die Sache etwas komplizierter, weil der Raum gleichmäßig mit kleineren Teilchen gefüllt ist. Die größeren roten Teilchen prallen nicht nur voneinander ab, sondern sie stoßen auch mit den kleineren Teilchen zusammen. Allerdings prallen die größeren nicht von den kleineren ab, sondern sie schieben die kleineren weg und ändern dabei ihre eigene Bewegung (Richtung und Geschwindigkeit) nur relativ wenig. Trotzdem werden die großen Teilchen anders als in einem leeren Raum mit der Zeit abgebremst und bewegen sich dann nur noch ungerichtet im Raum hin und her. Aus einer Region höherer Konzentration drängen aber große Teilchen nach und schubsen die bereits abgebremsten an. Dieser Effekt ist allerdings umso größer, je näher die abgebremsten Teilchen dem Bereich höherer Konzentration sind. Die Diffusion großer Farbmoleküle verläuft daher vom Zentrum der höchsten Konzentration zu den Rändern hin immer langsamer.
Noch wichtiger dürfte aber auch in diesem Fall die Ursache sein, dass natürlich immer mehr Teilchen aus der Richtung des Ortes kommen, an dem es noch mehr Teilchen gibt. Genau das ist letztlich auch die Ursache der Osmose.
Was ist Osmose?
|
|---|
Osmose nennt man den Effekt, dass durch eine semipermeable Membran mehr kleine Moleküle zu der Seite wechseln, auf der sich Ionen oder größere Moleküle in höheren Konzentrationen befinden.
Was könnte man in einem Osmose-Experiment beobachten
|
|---|
Die folgende Animation zeigt, was man mit bloßen Augen sehen könnte, wenn die dunkler dargestellte Flüssigkeit auf der rechten Seite mehr Ionen oder größere Moleküle enthielte. Links würde das Volumen der Flüssigkeit reduziert und daher der Wasserspiegel sinken. Rechts würde das Volumen der Flüssigkeit zunehmen und infolgedessen der Wasserspiegel steigen. Außerdem könnte man beobachten, dass die Volumenänderungen immer langsamer würden und schließlich ganz zum Stillstand kämen.
Welche Kraft stoppt den Anstieg des rechten Wasserspiegels?
|
|---|
Mit dem Volumen und dem Wasserspiegel steigt rechts auch die Masse des Wassers. Und aufgrund der Erdanziehung (Gravitations-Kraft) steigt mit der Masse auch das Gewicht des Wassers. Mit zunehmendem Gewicht der Wassersäule nimmt auch der Druck zu, mit dem die rechte Wassersäule auf die Wände des Behälters und auf die semipermeable Membran drückt. Man bezeichnet diesen Druck als Wasserdruck oder hydrostatischen Druck. Ein höherer Wasserdruck bedeutet, dass pro Sekunde mehr Wasser-Moleküle gegen die semipermeable Membran prallen (drücken). Und wenn mehr Wasser-Moleküle gegen eine semipermeable Membran prallen, dann gelangen auch mehr Wasser-Moleküle durch die Membran auf deren andere Seite. Die Ursache für die Verlangsamung der Osmose ist also der zunehmende hydrostatische Druck und die dafür verantwortliche Kraft ist die Gravitations-Kraft.
Entsprechend nimmt natürlich auf der linken Seite mit dem Volumen auch der hydrostatische Druck ab. Während der hydrostatische Druck auf der linken Seite ab und auf der rechten Seite zunimmt, entsteht eine zunehmende Differenz zwischen den hydrostatischen Drücken, also ein hydrostatischer Überdruck auf der rechten Seite. Dieser treibt immer mehr Wasser-Moleküle von rechts nach links durch die semipermeable Membran.
Während rechts der hydrostatische Überdruck zunimmt, nehmen gleichzeitig die Unterschiede hinsichtlich der Konzentrationen der auf beiden Seiten gelösten Stoffe ab. Denn solange noch insgesamt mehr Wasser auf die Seite mit der höheren Konzentration gelöster Stoffe fließt, verdünnt das zusätzliche Wasser diese gelösten Stoffe. Dadurch nimmt der osmotische Überdruck (Differenz zwischen den osmotischen Drücken links und rechts) etwas ab.
Die Zunahme des hydrostatischen Überdrucks und die Abnahme des osmotische Überdrucks bewirken beide, dass der Überschuss der von links nach rechts durch die semipermeable Membran gelangenden Wasser-Moleküle immer mehr abnimmt. Schließlich gelangen genau gleich viele Wasser-Moleküle von links nach rechts wie umgekehrt durch die semipermeable Membran, weil sich der osmotische und der hydrostatische Überdruck genau ausgleichen.
| Diagramme zum zeitlichen Verlauf sichtbarer Osmose-Effekte |
|---|
| Die Diagramme zeigen unterschiedliche Möglichkeiten, durch einfaches Skizzieren die zeitlichen Verläufe von Osmose-Effekten darzustellen. |
3 mögliche Ursachen für die Osmose
|
|---|
Ein entscheidender Faktor bei der Osmose ist die halbdurchlässige (semipermeable) Membran. Durch ihre Poren passen Wasser-Moleküle, aber keine größeren Moleküle. Etwas schwerer zu verstehen ist, dass auch keine Ionen durch die Poren wandern. Denn Ionen sind eher kleiner als die ungeladenen Atome oder Moleküle. Sind allerdings Ionen in Wasser gelöst, dann schwimmen sie nicht einfach frei im Wasser herum. Sondern jedes Ion ist umgeben von einer großen Hülle aus Wasser-Molekülen. Man nennt das eine Hydrat-Sphäre. Und die Ursache dafür sind zwei Eigenschaften des Wasser-Moleküls. Die folgende Grafik soll das erklären.
| Schema des Wasser-Moleküls |
|---|
|
|
|
Dieses Schema zeigt die Form und die Verteilung der elektrischen Ladungen des Wasser-Moleküls. Die 8 Protonen im Atomkern des Sauerstoff-Atoms ziehen viel stärker an den beiden Elektronen des gemeinsamen Elektronenpaars als das einzige Proton im Atomkern des Wasserstoff-Atoms. Deshalb halten sich die beiden Elektronen des bindenden Elektronenpaars mehr in der Nähe des Sauerstoff-Atoms auf. Und weil die Elektronen negativ geladen sind, befindet sich im Wasser-Molekül mehr negative Ladung am Sauerstoff-Atom, während die Wasserstoffatome eher positiv geladen sind. Hinzu kommt der Einfluss der gewinkelten Form des Wasser-Moleküls. Aufgrund des Molekül-Winkels von 104,45° bildet das Wasser-Molekül einen Dipol mit einem spitzen negativen und einem breiten positiven Pol. Der positive Pol des Wasser-Moleküls wird von negativ geladenen Ionen angzogen. Der negative Pol des Wasser-Moleküls wird von positiv geladenen Ionen angzogen. Deshalb bilden Wasser-Moleküle eine Hülle um jedes im Wasser gelöste Ion herum. |
In Texten und Lernvideos zur Osmose findet man häufig Erklärungen, die grob unsinnig sind und vor denen man sich hüten sollte. Man denke immer daran, dass Moleküle und Lösungen niemals irgend etwas wissen, denken oder wollen. Deshalb sind sie niemals bestrebt und WOLLEN auch keine Konzentrationsgefälle ausgleichen. Der folgende Lernkasten erklärt drei tatsächliche Osmose-Ursachen.
|
| Schema zur Veranschaulichung der Osmose-Ursachen |
|---|
| Die blauen Kreise stellen kleine polare Moleküle dar, die roten große unpolare. Positiv oder negativ geladene Teilchen sind hydratisiert (von den kleinen polaren Molekülen umgeben). |
Osmose bei Süß- und Seewasserfischen
|
|---|
| Schema zur Veranschaulichung der Osmose-Effekte bei Süß- und Seewasserfischen |
|---|
| Die roten Punkte sollen von Wasser-Molekülen umhüllte Salz-Ionen darstellen. Es geht aber nur um die Andeutung der Konzentrations-Unterschiede zwischen dem Wasser und den Zellen der Fische. In Süß- und Seewasserfischen ist die Ionen-Konzentrationen praktisch gleich. |
| Seewasserfische müssen ständig trinken, weil ihre Haut durch die Osmose permanent Wasser an die Umgebung abgibt. Deshalb brauchen sie besonders sauberes Wasser. Süßwasserfische müssen nicht trinken, weil durch die Osmose ständig Wasser in ihre Haut eindringt. Weil das Wasser dabei durch die semipermeablen Membranen gefiltert wird, können sie in relativ schmutzigem Wasser überleben. Sie müssen nur andauernd überschüssiges Wasser ausscheiden und den damit verbundenen Verlust von Mineralstoffen ausgleichen. |
Meine Skizzen sollen zeigen, was als Skizze in einer Klausur ausreichen würde. Auch mit deutlich weniger Pfeilen und Punkten würden sie den Anforderungen für eine Skizze in einer Klausur genügen. Die Zeichnungen unten sind natürlich schöner, aber in Klausuren geht es nicht um künstlerische Qualität. Diese Zeichnungen aus der Wikimedia Commons zeigen am Beispiel einer amerikanischen Bachforelle und einer Stachelmakrele nicht nur die Effekte der Osmose, sondern darüber hinaus die aktive Regulation der Wasser- und Mineralstoff-Haushalte durch die Fische.
| Schema zur Veranschaulichung des Osmose-Effekts und der aktiven Regulation der Wasser- und Salzhaushalte bei einem Süßwasserfisch |
|---|
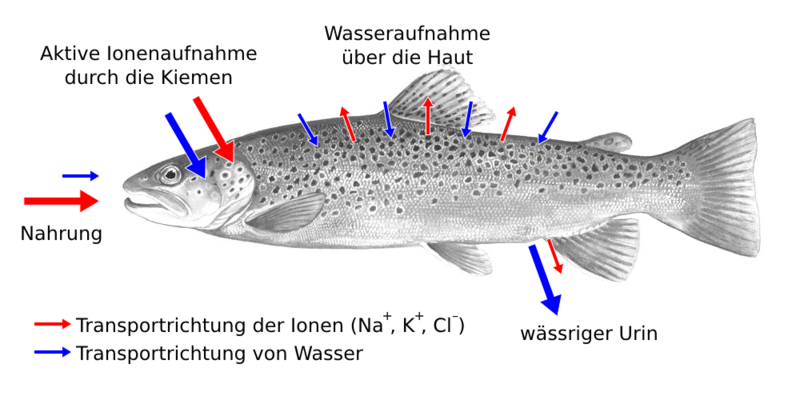 |
| Biezl auf der Grundlage einer Zeichnung von Duane Raver Jr., public domain |
| Schema zur Veranschaulichung des Osmose-Effekts und der aktiven Regulation der Wasser- und Salzhaushalte bei einem Seewasserfisch |
|---|
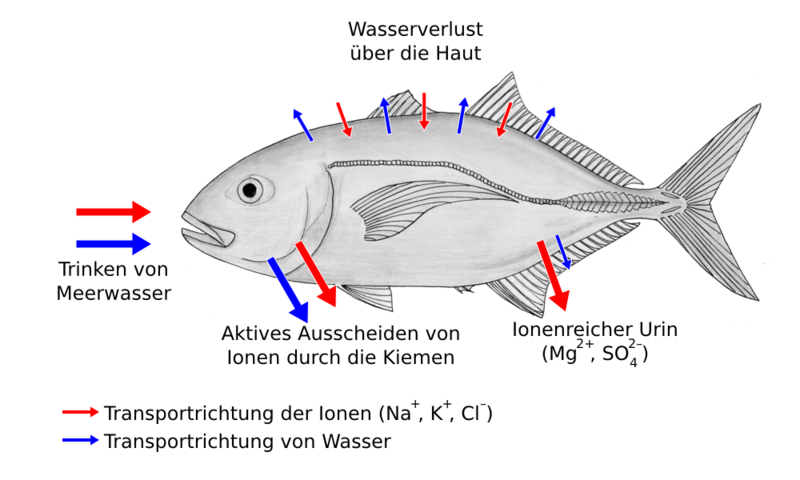 |
| Biezl auf der Grundlage einer Zeichnung von Kare Kare, CC BY-SA 3.0 |
hypotonische, isotonische und hypertonische Getränke und Medien
|
|---|
Die Vorsilbe: "hypo" bedeutet: "unter" oder: "weniger". Umgekehrt steht die Vorsilbe: "hyper" für: "über" oder: "mehr". Entsprechend kennen wir vom Blutdruck den Hypertonie genannten Bluthochdruck und den Hypotonie genannten niedrigen Blutdruck. Tonus nennt man das Ausmaß einer Anspannung, also einen Spannungszustand oder Druck. Die Vorsilbe: "iso" bedeutet: "gleich". Isotonisch nennt man ein Getränk oder generell eine Flüssigkeit, die hinsichtlich der Salz-Konzentration (z.B.: 0,9% NaCl) und des osmotischen Drucks (7,5 bar) dem Inneren unserer Zellen und unserem Blut entspricht. Diese Gleichheit hat den Vorteil, dass sie osmotische Effekte vermeidet.
Ein hypotonisches Getränk enthält weniger gelöste Stoffe als unser Blut. Der Extremfall wäre destilliertes Wasser, welches nahezu gar keine gelösten Stoffe enthält. Würden wir es in großen Mengen trinken, dann entstünde durch Vermischung mit Speichel, Magensaft und Nahrungsbrei ein leicht isotonischer Darm-Inhalt. Dann würde Osmose dazu führen, dass Wasser in die mehr gelöste Stoffe enthaltenden Schleimhaut-Zellen eindringt. Hauptsächlich durch die Zwischenräume zwischen den Schleimhaut-Zellen würde das relativ salzarme Wasser auch ins Blut aufgenommen. Dann könnte Osmose dazu führen, dass die roten Blutkörperchen (Erythrozyten) mehr Wasser aufnehmen. Um die Erythrozyten platzen zu lassen, müsste das destillierte Wasser aber durch eine Infusion direkt ins Blut gelangen. Trotzdem kann das Trinken extremer Mengen hypotonischer Getränke problematisch sein, weil dadurch ein Mangel an Mineralstoffen entstehen kann.
Die Homöostase der Mineralstoffe wird auch gestört, wenn Menschen größere Mengen Meerwasser oder ein ähnlich hypertonische Getränke konsumieren. Hat ein Mensch zuviel Salz im Darm, entzieht es der Darmschleimhaut durch Osmose Wasser, was zu Durchfall führt. Ein Teil der im Wasser gelösten Salz-Ionen gelangt durch die Zwischenräume zwischen den Zellen der Darmwand ins Blut und macht es hypertonisch. Dadurch wird den Erythrozyten Wasser entzogen. Sie schrumpfen ungleichmäßig und nehmen die sogenannte Stechapfelform an. Ich konnte dazu keine seriöse Quelle finden, aber wahrscheinlich beeinträchtigt diese Formveränderung die Bewegung der Erythrozyten durch die engen Kapillaren.
Osmotischer Druck heißt die Kraft, mit der ein Gas oder eine Flüssigkeit Teilchen durch eine semipermeable Membran drückt. Die Größe des osmotischen Drucks entspricht dem Druck, der aufgewendet werden muss, um in beiden Richtungen gleich viele Teilchenbewegungen zu erhalten. Verschiedene Quellen definieren allerdings den osmotischen Druck entweder als Eigenschaft jeder einzelnen Seite oder als Differenz zwischen den Drücken beider Seiten.
Osmotischer Wert ist ein veralteter Name für die Anzahl der osmotisch aktiven Teilchen pro Liter (Osmolarität) oder die Zahl der osmotisch aktiven Teilchen pro kg (Osmolalität).
| Osmotisches Zustandsdiagramm |
|---|
|
|
Das folgende Schema von Mariana Ruiz Villarreal zeigt links die Plasmolyse einer Pflanzen-Zelle in einem hypertonischen Medium. In der Mitte ist erkennbar, dass in isotonischem Medium die Zellmembran einer Pflanzen-Zelle nicht fest an der Zellwand anliegt. Deshalb kann das Zytoplasma keinen Wasserdruck (hydrostatischen Druck) auf die Zellwand ausüben. Die Pflanze wäre deshalb ziemlich schlaff. Rechts sieht man die fast vollendete Deplasmolyse in einem hypotonischen Medium.
| Plasmolyse und Deplasmolyse einer pflanzlichen Zelle |
|---|
| Mariana Ruiz Villarreal, public domain |
Everything you know about osmosis is (probably) wrong.
|
|---|
|
"Osmosis - the flow of a solvent across a semipermeable membrane from a region of lower to higher solute concentration - is a well-developed concept in physics and biophysics. The problem is that, even though the concept is important to plant and human physiology, osmosis is understood in biology and chemistry in a much simpler - and often incorrect - way." "A range of surprising misconceptions about osmosis continue to appear in papers, web sites and textbooks," says Eric Kramer, professor of physics at Bard College at Simon's Rock in Great Barrington, Mass. "Wrong ideas about osmosis are especially common in educational materials aimed at students of chemistry and biology. Once learned, these errors influence the thinking of professionals throughout their careers." Dick Jones Communications. "Everything you know about osmosis is (probably) wrong." ScienceDaily, 28 March 2013. |
Na toll! Wir Biologen verstehen also die Osmose nicht - schreibt ein Physiker und wundert sich. Denn viele Physiker verstehen nicht, warum sie von normalen Menschen nicht verstanden werden. Zeit genug hätten sie ja gehabt, die Physiker, uns Biologen und Chemikern die Osmose mal richtig zu erklären. Aber dazu müssten sie irgend eine normale Sprache sprechen und nicht nur Mathematik. Denn wie es aussieht, wenn Physiker die Osmose zu erklären versuchen, sieht man in dem angesprochenen Artikel: Eric Kramer & David R. Myers - Five popular misconceptions about osmosis - American Journal of Physics 80, 694 (2012); doi: 10.1119/1.4722325 (Original). Immer wenn es zur Sache geht und man endlich eine Erklärung lesen möchte, dann findet man statt anschaulicher Grafiken oder Animationen doch nur wieder Formeln, die kaum ein Biologe versteht.
Auch wenn ich den mathematischen Ausführungen nicht wirklich folgen kann, fürchte ich doch, dass die Physiker recht haben. Die meisten Biologen verstehen die Osmose wohl tatsächlich nicht vollständig. Auch ich kenne die dritte Osmose-Ursache in meiner Liste erst aufgrund dieses Artikels. Aber weil ich nicht einfach in der Abgeschiedenheit des Bioraums ungestört Unsinn erzählen möchte, mache mit meinen Seiten öffentlich und damit für Eltern und Experten nachprüfbar, was ich verstanden zu haben glaube und Lernenden erkläre. Lehrern fehlen normalerweise für diese Transparenz-Arbeit Zeit und technische Mittel, aber für Naturwissenschaftler ist es selbstverständlich, sich auf solche Weise ständig durch eigene Publikationen der Kritik zu stellen. Denn konstruktive Kritik ist für uns eine der wichtigsten Quellen der Erkenntnis.
Richtigstellung von 5 mutmaßlichen Osmose-Irrtümern
|
|---|
|
weiterführende Quellen
|
|---|
Eric Kramer & David R. Myers - Five popular misconceptions about osmosis - American Journal of Physics 80, 694 (2012); doi: 10.1119/1.4722325 (Original)
Dick Jones Communications. "Everything you know about osmosis is (probably) wrong." ScienceDaily, 28 March 2013
PC35 Lern-Video des physikalischen Chemikers Dr. Lauth: Osmose und Osmotischer Druck - Das Lösemittel wandert freiwillig in die konzentriertere Lösung
Kommentare und Kritik von Fachleuten, Lernenden und deren Eltern sind jederzeit willkommen.
Roland Heynkes, CC BY-NC-SA 4.0