

Dieser Hypertext soll möglichst verständlich erklären, was man über physikalische Grundlagen für das Verständnis von Chemie und Biologie wissen sollte. In einigen Kapiteln dieses Selbstlern-Hypertextes gibt es Übungsmodule mit klausurähnlichen Aufgaben.
Regeln für die Arbeit mit Aufgaben und Material
|
 |
Zwei grundverschiedene Arten von Teilchen |
|---|---|
 |
Atome-Versteher haben es leichter. |
 |
Es ist nur nicht ganz leicht, einer zu werden. |
 |
Luftwiderstand ist für Atome und Elektronen kein Problem. |
 |
Atome haben auch keine Knautschzone. |
 |
Temperatur, Wärmeenergie und Wärme |
 |
grundlegendes zum Thema Energie |
 |
Aggregatzustände |
 |
Thermometer |
 |
In der Welt der winzigen Atome treten Quanteneffekte auf. |
 |
Auch Licht ist gequantelt. |
 |
Farben können unterschiedliche Ursachen haben. |
 |
Die Farben nicht selber leuchtender Objekte. |
 |
Die Farben selber leuchtender Objekte. |
 |
Die Welt der Atome kann man nicht heimlich beobachten. |
 |
Diffusion und Osmose |
Zwei grundverschiedene Arten von Teilchen
|
|---|
|
Zur Einführung hat Frau Ende das witzige YouTube-Video: "Teilchenmodell - Atome - Moleküle - musstewissen Chemie" von Frau Dr. Mai Thi Nguyen-Kim für Euch gefunden. In den Einstellungen könnt Ihr bei YouTube-Videos das Abspieltempo für Euch angenehm einstellen. Für die eher physikalisch Interessierten hat Herr Rösener bei YouTube ein passendes Physik-Video gefunden: Drei Arten von Elementarteilchen. Keine Panik, wenn Ihr dieses Video nicht versteht! Die Biologie kann man auch ohne Quarks und Bosonen verstehen. Es ist nützlich, sich wichtige Inhalte von verschiedenen Menschen unterschiedlich erklären zu lassen. Deshalb trifft es sich gut, dass Herr Rösener für Euch zu diesem Kapitel eine zusätzliche Erklärung mit Beispielen geschrieben hat. |
Tipps von Herrn Rösener für die Bearbeitung der folgenden Aufgaben 1 und 2:
| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| a1 | Nenne die beiden bis jetzt bekannten, völlig unterschiedlichen Arten von Teilchen! |
| a2 | Beschreibe die Eigenschaften, in denen sich die beiden Teilchen-Arten fundamental unterscheiden! |
| a3 | Erkläre den Namen Atom! |
| Hier geht es zu den Antworten. | |
| Expertenaufgaben von Herrn Rösener: | |
|---|---|
| E1 ** | Erkläre, worin sich die Bosonen von den anderen Teilchenarten unterscheiden. |
| E2 ** | Nenne Beispiele für Bosonen. |
| E3 *** | Ein Magnet zieht einen Eisenstab an. Erkläre, woher der Eisenstab "weiß", dass der Magnet in der Nähe ist. |
| Diese Expertenaufgaben kannst die du Lösen, wenn du schon mit den Pflichtaufgaben fertig bist. Dabei gibt es drei Schwierigkeitsstufen, die mit Sternchen gekennzeichnet sind (* = leicht bis *** = schwierig). | |
Unsere Welt besteht vereinfacht gesagt aus zwei Arten von Teilchen. Das sind Licht-Teilchen und Materie-Teilchen. Beide sind so seltsam, dass wir nicht wirklich verstehen können, was und wie sie sind. Aber einige ihrer Eigenschaften kann und sollte man kennen. Im Gegensatz zu den Materie-Teilchen haben die auch Photonen genannten Licht-Teilchen keine Masse. Deshalb können sie sich im Vakuum mit Lichtgeschwindigkeit bewegen und darum können sich beliebig viele Licht-Teilchen genau am selben Platz befinden. Jedes bis jetzt bekannte Material im Universum besteht aus den Materie-Teilchen. Sie bilden sogenannte Atome. Der Name Atom bedeutet: "das Unteilbare". Man nannte sie so, weil man sie für die kleinsten Teilchen hielt, aus denen alle Materie besteht. Und tatsächlich sind Physiker die einzigen Menschen, die sogar Atome zerlegen können. Den Aufbau der Atome müssen aber alle Menschen kennen, die etwas von Chemie oder Biologie verstehen wollen.
Bitte auswendig lernen und nicht wieder vergessen!
|
Atome-Versteher haben es leichter. (pdf)
|
|---|
|
Von Herrn Rösener gibt es auch zu diesem Kapitel eine ausdruckbare pdf-Datei mit alternativen Erklärungen. Auch zu diesem Kapitel hat Frau Ende ein passendes YouTube-Video: "Die Atom-Masse" von Frau Dr. Mai Thi Nguyen-Kim für Euch gefunden. Nett erklärt findet Ihr das Periodensystem in zwei YouTube-Videos von Frau Dr. Mai Thi Nguyen-Kim, die Herr Rösener für Euch gefunden hat: |
| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| b1 | Erkläre, warum man die Positionen einiger wichtiger chemischer Elemente im Periodensystem kennen sollte! |
| b2 | Nenne mit Hilfe des Periodensystems die jeweilige Ordnungszahl und das Atomgewicht von Wasserstoff, Kohlenstoff, Gold, und Silber. |
| b3 | Übertrage die Legende des Periodensystems sauber und in Farbe in deine Unterlagen. |
| b4 | Nenne den Einheits-Buchstaben mit dem das Atomgewicht (die Masseneinheit ma) beschrieben wird! |
| b5 | Notiere anhand des Periodensystems die Masse (Atomgewicht) von Sauerstoff! |
| b6 | Berechne mit Hilfe der Beispielrechnung aus dem Video zur Masse von H2O die Masse eines CO2-Moleküls! |
| Hier geht es zu den Antworten. | |
| Expertenaufgabe von Herrn Rösener: | |
|---|---|
| 1 | E4**: Finde dir folgenden Elemente im Periodensystem und nenne jeweils, welche Eigenschaften du über diese Elemente erfährst: Neon, Eisen, Uran |
| Expertenaufgaben kannst die du Lösen, wenn du schon mit den Pflichtaufgaben fertig bist. Dabei gibt es drei Schwierigkeitsstufen, die mit Sternchen gekennzeichnet sind (* = leicht bis *** = schwierig). | |
Anstatt die Eigenschaften und chemischen Reaktionen der chemischen Elemente und ihrer chemischen Verbindungen mühsam zu pauken und viel zu schnell wieder zu vergessen, sollte man lieber lernen, was die Eigenschaften der Atome bestimmt. Dann muss man nämlich fast nur noch wissen, wo im Periodensystem ein chemisches Element steht. Aus den Positionen im Periodensystem kann man meistens relativ leicht ablesen, ob bzw. wie Atome mit einander reagieren werden und welche Eigenschaften die Reaktionsprodukte haben werden.
| Periodensystem der chemischen Elemente |
|---|
|
|
| Dr. Peter Cüppers, Public domain |
| Das Periodensystem ordnet die chemischen Elemente nach der Zahl ihrer Protonen, Valenzelektronen und Eigenschaften so, dass Elemente mit ähnlichen Eigenschaften untereinander stehen. |
Ein chemisches Element ist eine Atom-Sorte. Die chemischen Elemente unterscheiden sich durch die Zahl ihrer Protonen. Wasserstoff-Atome können 0, 1 oder zwei Neutronen im Atomkern haben. Aber alle Wasserstoff-Atome und ausschließlich Wasserstoff-Atome haben immer genau 1 Proton im Atomkern. Im Periodensystem sind die Chemischen Elemente nach der Zahl ihrer Protonen geordnet. Ganz oben links steht das Chemische Element Wasserstoff mit nur 1 Proton. Rechts daneben steht das Chemische Element Helium, dessen Atome alle genau 2 Protonen enthalten. Wasserstoff und Helium sind die beiden einzigen chemischen Elemente in der obersten Reihe des Periodensystems, weil die innerste Schale der Atomhülle nur Platz für 2 Elektronen hat. Deshalb hat Helium mit nur 2 Elektronen schon eine volle äußerste Schale. Darum steht es genau wie Neon in der Spalte aller Edelgase. Allen Edelgasen gemeinsam ist die volle äußerste Elektronenschale. Das ist ein Zustand, den alle chemischen Elemente anstreben.
| Die Elektronenschalen der ersten 10 chemischen Elemente |
|---|
|
|
| Das Schema zeigt die Atomkerne und die Elektronenschalen der ersten 10 chemischen Elemente des Periodensystems nach Art des einfachen Atom-Modells von Niels Bohr. |
In der zweiten Zeile stehen alle chemischen Elemente mit 2 Elektronenschalen. Und auch in der zweiten Zeile des Periodensystems unterscheiden sich die chemischen Elemente durch die von links nach rechts immer um 1 zunehmende Zahl der Protonen in den Atomkernen.
In den elektrisch neutralen Atomen befinden sich immer gleich viele positiv geladene Protonen und negativ geladene Elektronen.
Obwohl im Periodensystem von links nach rechts innerhalb einer Zeile die Atomkerne immer größer werden, nimmt gleichzeitig der Durchmesser der Atome von links nach rechts ab. Das liegt daran, dass die Atomkerne der chemischen Elemente in einer Zeile des Periodensystems von links nach rechts immer mehr Protonen enthalten. Denn je mehr elektrisch positiv geladene Protonen im Atomkern an den elektrisch negativ geladenen Elektronen in der Atomhülle ziehen, desto enger rücken die Elektronenschalen an den Atomkern heran.
| Periodensystem der chemischen Elemente |
|---|
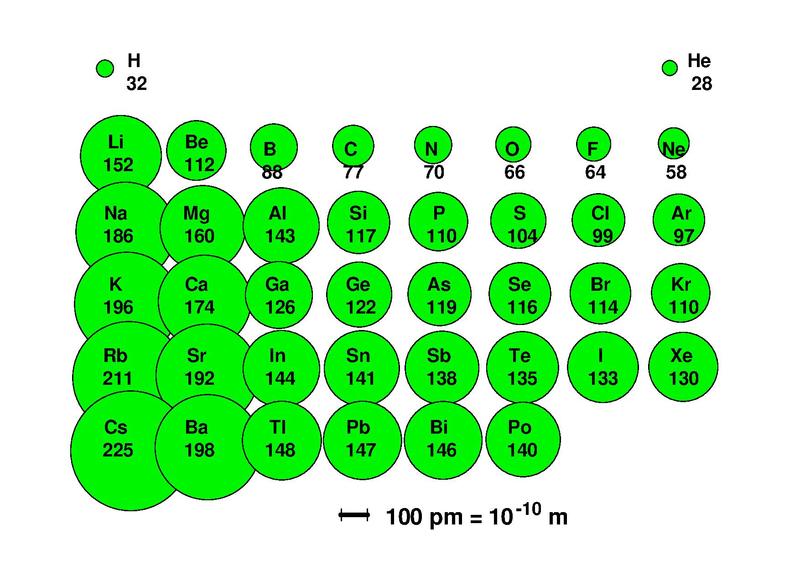
|
| Bleckneuhaus, CC BY-SA 3.0 |
| Das Periodensystem ordnet die chemischen Elemente nach der Zahl ihrer Protonen, Valenzelektronen und Eigenschaften so, dass chemische Elemente mit ähnlichen Eigenschaften untereinander stehen. |
Lernen für die Klassenarbeit:
|
Es ist nur nicht ganz leicht, einer zu werden.
|
|---|
Bevor Lernenden die chemischen Elemente zu vertrauten und in ihrem Verhalten vorhersagbaren Bekannten werden, müssen die Atome an sich verstanden werden. Das ist garnicht so leicht, weil sie kaum vorstellbar viel kleiner sind als unsere wahrnehmenbare Umgebung. In der Welt der Atome treten ganz andere Effekte auf, als wir sie aus unserem Erleben gewohnt sind und als wir sie intuitiv erwarten oder sogar als vermeintlich selbstverständlich voraussetzen. Darum sollen die folgenden Kapitel die für Chemie und Biologie wichtigsten Effekte erklären.
Luftwiderstand ist für Atome und Elektronen kein Problem. (pdf)
|
|---|
|
Von Herrn Rösener gibt es auch zu diesem Kapitel eine ausdruckbare pdf-Datei mit alternativen Erklärungen. Frau Ende und Herr Rösener haben für Euch folgende vertiefende Videos gefunden: Zu den Aufgaben 6, 7 und 8 erfährst du mehr über das Experiment von Rutherford und sein Atom-Modell in den folgenden beiden YouTube-Videos: Zu Aufgabe 5 erfährst du mehr über den Luftwiderstand beim Menschen im Youtube-Video: "Der Luftwiderstand - Beispiel Radfahren". |
| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| c1 | Erkläre den Unterschied zwischen raschen Bewegungen von Atomen und Menschen! |
| c2 | Beschreibe mit nur einem kurzen Satz die Beobachtung von Ernest Rutherford in seinem berühmten Streuungsexperiment! |
| c3 | Fasse in nur einem Satz zusammen, welche wichtige Erkenntnis das Streuungsexperiment von Sir Ernest Rutherford lieferte! |
| c4 | Nenne den Durchmesser, den ein Atom hätte, wenn der Durchmesser seines Atomkern 1 Millimeter wäre! |
| Hier geht es zu den Antworten. | |
| Expertenaufgabe von Herrn Rösener: | |
|---|---|
| 1 | E5**: Zähle auf, von welchen vier Faktoren der Luftwiderstand beim Radfahren abhängt. |
| Expertenaufgaben kannst die du Lösen, wenn du schon mit den Pflichtaufgaben fertig bist. Dabei gibt es drei Schwierigkeitsstufen, die mit Sternchen gekennzeichnet sind (* = leicht bis *** = schwierig). | |
Vom Fahrrad- oder Autofahren sind wir es gewohnt und halten es intuitiv für ein Naturgesetz, daß man ständig in die Pedale treten oder wenigstens Gas geben muß, wenn man eine bestimmte Geschwindigkeit halten will. Denn Autos und Radfahrer werden durch den Luftwiderstand ständig abgebremst. Von unserem Größenmaßstab aus betrachtet sind wir nämlich ganz dicht von unzähligen Luft-Molekülen umgeben und können uns keinen Millimeter bewegen, ohne mit ihnen zu kollidieren. Dem gesunden Menschenverstand scheint daher die Feststellung der Physiker zu widersprechen, daß sich bewegende Atome oder Elektronen nicht durch eine Art Roll- oder Luftwiderstand langsam abgebremst werden. Bis in die Neuzeit hinein konnten nur wenige Menschen die schon in der Antike von Leukipp, Demokrit und Epikur als Notwendigkeit erkannte Vorstellung akzeptieren, daß sich insbesondere in Gasen zwischen den Teilchen einfach nichts als völlig leerer Raum befindet. Das ist aber so, weil Atome kaum vorstellbar klein sind. Atome sind so klein, dass auf 1 Millimeter von den größten mehr als 2 Millionen und von den kleinsten fast 16 Millionen nebeneinander liegen könnten. Die ungefähren Atom-Durchmesser liegen zwischen 56-280 (Helium) und 520-700 (Francium) Pikometern.
| Atomradien der chemischen Elemente im Periodensystem |
|---|
|
|
| Johannes Schneider, CC BY-SA 4.0 |
Zwischen den weniger als 1 Millionstel Millimeter großen Atomen fliegen einfach keine noch kleineren Teilchen herum, von denen die Atome abgebremst werden könnten. Darum fliegen Atome und Moleküle völlig ungebremst durch die Luft, bis sie mit einem anderen Atom oder Molekül zusammenprallen. In atomaren und subatomaren Größenordnungen wird daher Energie nur für positive (schneller werden), negative (abbremsen) und seitliche Beschleunigungen gebraucht, nicht aber für die Aufrechterhaltung einer geradlinigen und gleichmäßigen Bewegung.
Wie zuerst Sir Ernest Rutherford zwischen 1911 und 1913 mit seinem berühmten Streuungsexperiment zeigen konnte, ist selbst innerhalb eines Atoms zumindest die Atomhülle ein fast leerer Raum, in dem die Elektronen nicht abgebremst werden. Andernfalls wären längst alle Elektronen in ihre Atomkerne gestürzt und es gäbe im Universum keine Atome mehr. Der Atomkern enthält auf sehr kleinem Raum fast die gesamte Masse eines Atoms. Besäße ein Atomkern einen Durchmesser von einem Millimeter, dann überträfe die Fläche eines Querschnittes durch die praktisch leere Atomhülle mit einem Durchmesser von rund 100 Metern deutlich die Fläche eines Fußballfeldes. Die Durchmesser der Atome sind 20.000-150.000 mal größer als die Durchmesser der massiven Atomkerne. (beim Wasserstoff etwa 1,7 x 10-15 Meter oder 1,7 Fermi und für die übrigen chemischen Elemente nach einer empirisch gewonnenen Näherungsformel (Kerndurchmesser = 2,4 x 10-15 Meter x relative Atommasse1/3) etwa 2-15 Fermi. In der Atomhülle gibt es genauso viele negativ geladene Elektronen, wie der Atomkern positiv geladene Protonen enthält. Elektronen besitzen nur rund ein Zweitausendstel der Protonen-Masse und man konnte bei ihnen bisher weder eine Ausdehnung noch eine Strukturierung nachweisen (https://de.wikipedia.org/wiki/Elektron#Klassischer_Radius_und_Punktf%C3%B6rmigkeit). Also besteht die Atomhülle fast nur aus leerem Raum, in welchem Atomkern und Elektronen durch Anziehungs- bzw. Abstoßungskräfte ihre Bewegungen gegenseitig beeinflussen, in dem aber keine Bewegungsenergie durch Reibung verloren geht.
| Durchmesser der Atomkerne sind unverstellbar klein. |
|---|
|
|
| anonym, CC BY-SA 3.0 |
Lernen für die Klassenarbeit:
|
Atome haben auch keine Knautschzone. (pdf)
|
|---|
|
Von Herrn Rösener gibt es auch zu diesem Kapitel eine ausdruckbare pdf-Datei mit alternativen Erklärungen. Zu diesem Kapitel gibt es eine Version in vereinfachter Sprache von Frau Ende. |
| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| d1 | Erkläre, warum beim Zusammenprall zweier Atome ihre kinetischen Energien (Bewegungsenergien) nur umverteilt werden! |
| d2 | Erkläre, auf welche Weise chemische Reaktionen zu Temperaturänderungen führen! |
| Hier geht es zu den Antworten. | |
Für uns sehr ungewohnt ist auch die Tatsache, daß beim Zusammenprall zweier Atome nicht wenigstens ein Teil ihrer kinetischen Energie für Verformungen verbraucht oder in Wärme umgewandelt wird. Aber im nahezu leeren Raum der Atomhülle sind die Elektronen nicht fest montiert. Sie können verschoben werden. Und mangels starrer Verbindungen können Atome nicht dauerhaft verformt werden. Deshalb können Atome noch viel besser als die besten Gummibälle zusammen gedrückt werden und anschließend wieder ihre ursprüngliche Form annehmen, ohne das dabei Energie verloren geht. Darum geht auch keine Bewegungsenergie (kinetische Energie) verloren, wenn zwei Atome zusammenprallen. Ähnlich wie im nachfolgenden Video zu sehen (funktioniert leider nicht mit jedem Browser), kann aber ein Atom oder Molekül seine Bewegungsenergie auf ein anderes übertragen.
| Kugelstoß-Modell im Erlebnisland Mathematik der Technischen Sammlungen Dresden |
|---|
| Jeremy Wolf, CC BY-SA 4.0 |
Wenn der eigene Browser obiges Video nicht anzeigen kann, findet man ein genauso gutes bei Youtube.
Die Atome, Moleküle und Ionen selber sind ja nicht von einem noch feineren Medium umgeben, sondern von ungefähr gleich großen Teilchen. Wenn sie zusammenstoßen, dann prallen sie normalerweise von einander ab und die kinetische Energie der beteiligten Teilchen wird in vollkommen elastischen Stößen umverteilt, bleibt aber insgesamt gleich, sofern sie nicht teilweise in chemische Energie umgewandelt wird. Wenn der Zusammenstoß von Atomen, Molekülen oder Ionen zu einer chemischen Reaktion führt, dann kann dabei die in den chemischen Bindungen steckende chemische Energie insgesamt zu- oder abnehmen. Da diese chemische Energie ja irgendwo herkommen oder bleiben muss, ändert sich in solchen Fällen natürlich auch die kinetische Energie der beteiligten Teilchen. Sie können sich danach langsamer oder schneller bewegen. Da eine insgesamt schnellere oder langsamere Bewegung der Teilchen nichts anderes als eine Erhöhung oder Absenkung der Temperatur ist, kann man an der Temperaturänderung erkennen, ob eine chemische Reaktion die insgesamt in den chemischen Bindungen steckende chemische Energie steigert oder senkt.
Lernen für eine Klassenarbeit:
|
Temperatur, Wärmeenergie und Wärme
|
|---|
Leider können viele Menschen nicht zwischen den Begriffen Temperatur, Wärmeenergie und Wärme unterscheiden. Dadurch kann es im naturwissenschaftlichen Unterricht zu Missverständnissen kommen. Darum versuche ich die drei Begriffe möglichst verständlich zu erklären.
|
Zu diesem Kapitel gibt es eine Ergänzung in vereinfachter Sprache von Frau Ende und zum besseren Verständnis zusätzliche Informationen von Herrn Rösener. Außerdem hat Herr Rösener für Euch ein passendes YouTube-Video gefunden. |
| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| e1 | Definiere mit Hilfe dieses Kapitels die Begriffe Temperatur und Wärme! |
| e2 | Entwickle eine Hypothese (Versuche zu erklären), auf welche Weise die Moleküle heißer Luft die Haut erwärmen (Wärme übertragen)! |
| Hier geht es zu den Antworten. | |
Die durchschnittliche kinetische Energie der Atome und Moleküle ist für uns in unserer makroskopischen Welt die Temperatur. Vereinfacht ausgedrückt ist die Temperatur ein Maß für die durchschnittliche Bewegungsenergie, mit der sich die Atome und Moleküle in Gasen, Flüssigkeiten oder Körpern ungerichtet hin und her bewegen.
In Gasen wie der Luft fliegen die Moleküle bei hohen Temperaturen schneller und bei tiefen Temperaturen langsamer. Aber nicht nur in der Luft sind Atome und Moleküle ständig in Bewegung. In Festkörpern zittern sie auf ihren festen Plätzen. Und je schneller die Atome in festen Körpern wie Steinen schwingen, desto wärmer ist das Material. Im Grunde ist die Temperatur ein Maß für die durchschnittliche Geschwindigkeit, mit der die Atome und Moleküle in Gasen herumfliegen oder in Festkörpern schwingen.
Temperatur ist eine innere Eigenschaft eines Gases, einer Flüssigkeit oder eines Körpers, die sich nicht halbiert, wenn man den Gegenstand oder die Menge des Gases bzw. der Flüssigkeit halbiert.
gelegentlich irrtümlich brownsche Molekularbewegunggenannte Wärmebewegung in einem Stück Alphahelix 
|
|---|
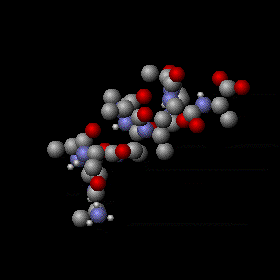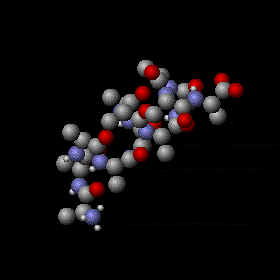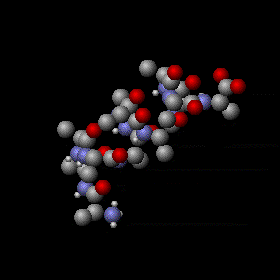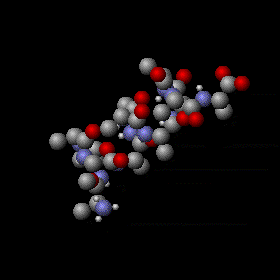
|
| anonym, CC BY-SA 3.0 |
Wenn wir im Alltag sagen, dass etwas warm ist oder dass wir die Wärme lieben, dann meinen wir damit eine angenehme Temperatur, die nicht zu kalt und nicht zu heiß ist. In den Naturwissenschaften benutzen wir aber den Begriff Wärme so, wie ihn die Physiker definieren. Demnach ist Wärme eineWärmeenergiemenge, die durch Wärmeleitung, Wärmestrahlung oder ein strömendes Medium von etwas wärmerem auf etwas kühleres übertragen wird.
Der Unterschied zwischen Temperatur und Wärme wird besonders deutlich, wenn wir die Wirkungen von heißer Luft und heißem Wasser vergleichen. 50°C heiße Luft bereitet uns keine Schmerzen, während wir ein Bad in 50°C heißem Wasser schon nach wenigen Sekunden als unerträglich empfinden würden. Obwohl die Luft und das Wasser die gleiche Temperatur hätten, würde nämlich im Wasser sehr viel mehr Wärme auf die Haut übertragen, weil Wasser viel dichter ist als Luft. Dadurch prallen pro Sekunde im Wasser sehr viel mehr Moleküle gegen die Haut als in der Luft. Und in den meisten Fällen wird dabei etwas Wärme (Energie) auf die Haut übertragen. Hinzu kommt dabei allerdings noch der Effekt, dass wir im Wasser nicht schwitzen und darum weniger Wärme abgeben können.
Wärmeenergie oder thermische Energie ist die Bewegungsenergie, die in der ungeordneten Bewegung aller Atome und Moleküle eines Gases, einer Flüssigkeit oder eines Körpers steckt.
Lernen für eine Klassenarbeit:
|
grundlegendes zum Thema Energie
|
|---|
| Fragen zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| f1 | Nenne verschiedene Energieformen! |
| f2 | Erkläre, was mit den oft benutzten Begriffen, Energieverlust, Energieerzeugung und Energieverbrauch nicht stimmt! |
| f3 | Nenne die im Lerntext beschriebenen Energie-Umwandlungen! |
| f4 | Definiere den Begriff Energiefluss! |
| f5 | Beschreibe einen Energiefluss! |
| f6 | Erkläre den Begriff Energieentwertung! |
| f7 | Erkläre den Unterschied zwischen sogenannten erneuerbaren Energien und fossilen Brennstoffen! |
| f8 | Nenne zwei mögliche Formen Formen der Energieeinsparung! |
| f9 | Definiere den Wirkungsgrad der Energie! |
| Hier geht es zu den Antworten. | |
Energie wird von Physikern als die physikalische Größe definiert, die wegen der zeitlichen Unveränderlichkeit der Naturgesetze in der Summe ihrer verschiedenen Erscheinungsformen immer gleich groß bleibt. Dem entsprechend besagt der Energieerhaltungssatz, dass die Gesamtenergie eines abgeschlossenen Systems weder vermehrt noch reduziert werden kann.
Das Problem dieser Definition ist allerdings, dass sie für Nichtphysiker schwer verständlich ist und außerdem nicht wirklich erklärt, was Energie ist. Nicht ganz korrekt, aber nützlicher für das Verständnis ist die ältere Definition, nach welcher Energie das ist, was die Verrichtung von Arbeit möglich macht. Man braucht Energie, um Körper zu beschleunigen, um etwas zu erwärmen, um Gase zusammenzudrücken, um elektrischen Strom fließen zu lassen oder um elektromagnetische Wellen abzustrahlen. Lebewesen benötigen Energie, um ihre komplexe innere Ordnung zu erhalten. Haben wir keine Energie mehr, dann beginnen unsere Körper sehr bald zu zerfallen, sofern sie nicht durch große Kälte oder andere Mittel der Konservierung davor bewahrt werden.
Ohne wirklich genau zu wissen, was Energie eigentlich ist, kennen wir alle verschiedene Formen von Energie: Wärmeenergie (thermische Energie), Kernenergie (Kernbindungsenergie), elektrische Energie, Bewegungsenergie (kinetische Energie), Strahlungsenergie, chemische Energie und vielleicht auch schon potentielle Energie (Energie der Lage).
In unserer Alltagssprache ist oft von Energieerzeugung, Energieverbrauch oder Energieverlust die Rede. Physiker konnten allerdings nachweisen, dass diese Begriffe alle physikalisch falsch und irreführend sind. Energie kann nämlich weder erzeugt, noch vernichtet werden. Die Physiker nennen diese wichtige Erkenntnis: "Energieerhaltungssatz". Also kann Energie an sich auch nicht verbraucht werden oder verloren gehen.
Energie kann aber von einer Energieform in eine andere umgewandelt werden. Bei jeder Energieumwandlung bleibt die Energie vollständig erhalten und wechselt lediglich in eine andere Energieform bzw. meistens in zwei andere Energieformen, von denen eine immer Wärmeenergie ist.
Beispielsweise wandeln wir die chemische Energie aus unserer Nahrung in Bewegungsenergie und Wärme um. Batterien wandeln bei Bedarf chemische in elektrische Energie und Wärme um. Grüne Pflanzen wandeln Strahlungsenergie in chemische Energie und Wärme um.
Die bei jeder Energieumwandlung zumindest auch entstehende Wärmeenergie ist allerdings den anderen Energieformen für uns Menschen und andere Lebewesen nicht gleichwertig, weil Wärmeenergie in geringen Mengen bzw. Konzentrationen nicht mehr für weitere, aus unserer Sicht wertvolle Energieumwandlungen genutzt werden kann. Weil bei jeder Energieumwandlung ein Teil der Energie in normalerweise nicht mehr nutzbare Wärmeenergie umgewandelt wird, spricht man von einer Energieentwertung. Physikalisch betrachtet ist das allerdings nicht richtig, weil die Wärmeenergie in Gasen, Flüssigkeiten oder Festkörpern steckt, die selbst bei sehr niedrigen Temperaturen die Wärmeenergie in Strahlungsenergie umwandeln und abstrahlen.
Soweit bisher bekannt, kann außer modernen Menschen kein Lebewesen Wärme in eine andere Energieform umwandeln. Mit der Wärmeenergie endet daher jeder biologische Energiefluss. Wir können allerdings mit Hilfe von Wärmepumpen die in unserer Umwelt auch bei niedrigen Temperaturen vorhandene Wärmeenergie nutzen, um beispielsweise Wände und Fußböden zu erwärmen, die dann ihrerseits die Wärmeenergie umwandeln und als wärmende (infrarote) Strahlungsenergie abstrahlen.
Oft wird die Energie über eine Kette von Energiewandlern immer weitergegeben. Dann spricht man von einem Energiefluss. Folgendes Beispiel mag das veranschaulichen. Als erster Energiewandler wandelt eine Kartoffel-Pflanze die Strahlungsenergie des Sonnenlichts um in die chemische Energie der Stärke. Oberflächlich betrachtet geht dabei ein Teil der nutzbaren Energie verloren, weil dabei auch scheinbar nicht mehr nutzbare Wärme entsteht. Der zweite Energiewandler ist ein Mensch, der die chemische Energie der Kartoffel-Stärke unter anderem in Bewegungsenergie und Wärme umwandelt. Der dritte Energiewandler ist ein Dynamo, der beim Radfahren einen kleinen Teil der Bewegungsenergie in elektrische Energie und Wärme umwandelt. Der vierte Energiewandler ist schließlich das Leuchtmittel (Glühbirnchen oder LED), welches die elektrische Energie in Strahlungsenergie und Wärme umwandelt.
In früheren Erdzeitaltern (vor mehr als zehntausend Jahren) entstanden aus abgestorbenen Lebewesen die sogenannten fossilen Brennstoffe Torf, Kohle, Öl und Gas. Wir verbrauchen fossile Brennstoffe in sehr viel größeren Mengen, als nachgebildet werden können. Deswegen werden die Vorräte früher oder später praktisch aufgebraucht sein. Im Gegensatz dazu werden die sogenannten erneuerbaren Energien ständig von der Sonne nachgeliefert. Die Strahlungsenergie der Sonne erzeugt den Wind, treibt den Wasserkreislauf an und wird von Pflanzen zur Erzeugung von Holz und anderer Biomasse genutzt. Die Energien von Sonne, Wind, fließendem Wasser und Biomasse werden uns daher praktisch ewig in ausreichender Menge für die Umwandlung in elektrische und chemische Energie zur Verfügung stehen.
Um negative Auswirkungen der Verbrennung fossiler Brennstoffe zu reduzieren, bietet sich auch das "Energiesparen" oder genauer gesagt eine Reduktion der von Menschen zu ihrem kurzfristigen Nutzen herbeigeführten Energieumwandlungen an. Man kann den Verbrauch nutzbarer Energie senken, indem man beispielsweise mit niedrigeren Raumtemperaturen oder Geschwindigkeiten auf ihre Nutzung verzichtet oder indem man die Energie mit sparsameren Geräten (z.B. LED-Lampen anstatt Glühlampen) oder besser isolierten Gebäuden effizienter nutzt. Wie der katastrophale Hochhausbrand in London zeigte, sollte man dabei aber andere wichtige Ziele wie den Brandschutz nicht vernachlässigen.
Eine normalerweise nebenwirkungsfreie Möglichkeit der Vermeidung überflüssigen Verbrauchs nutzbarer Energie ist eine Steigerung des Wirkungsgrades all unserer technischen Energiewandler. Wirkungsgrad einer Energieumwandlung oder eines Gerätes heißt das Verhältnis der für den geplanten Zweck genutzten zur eingesetzten Energie.
Nicht vergessen!
|
Checkliste für eine Klassenarbeit:Ich kann ...
|
Aggregatzustände
|
|---|
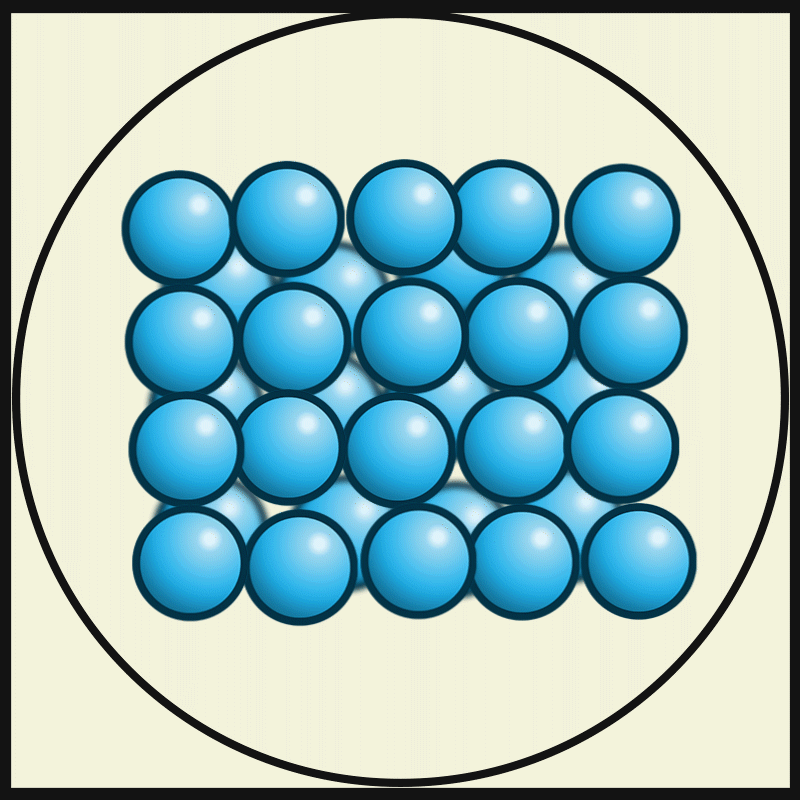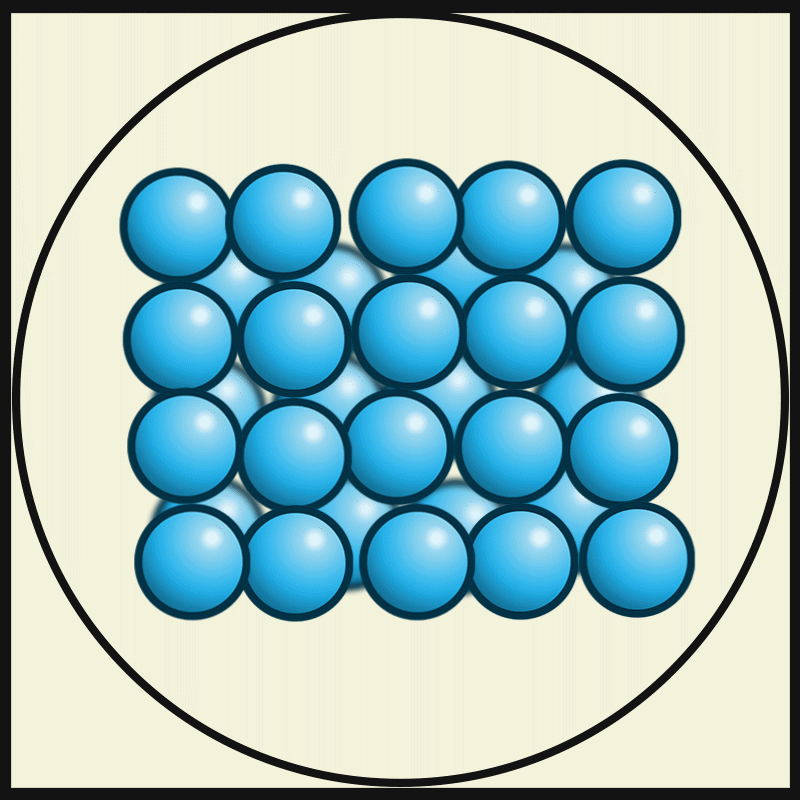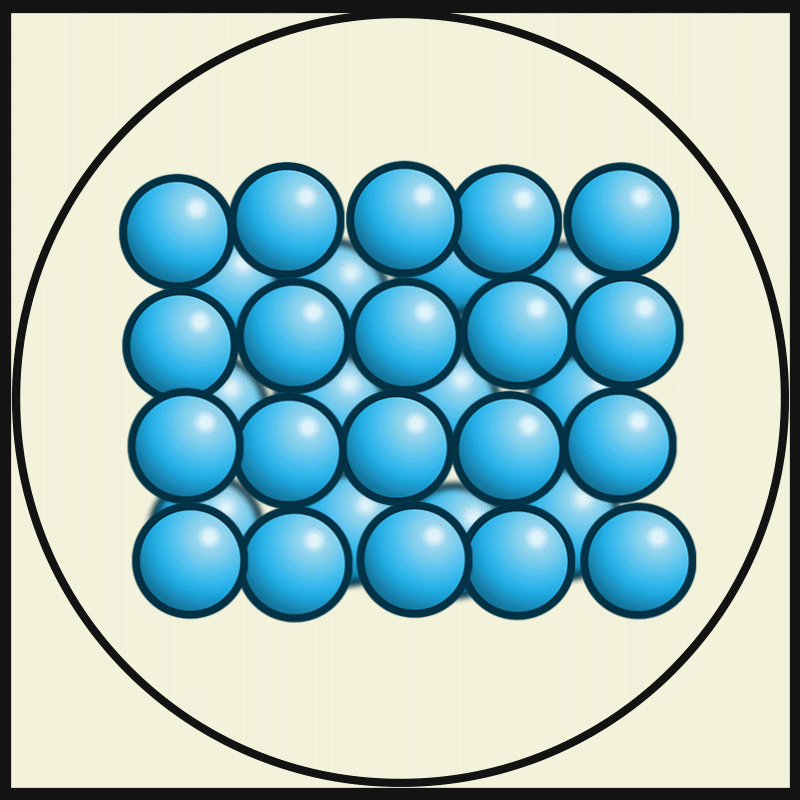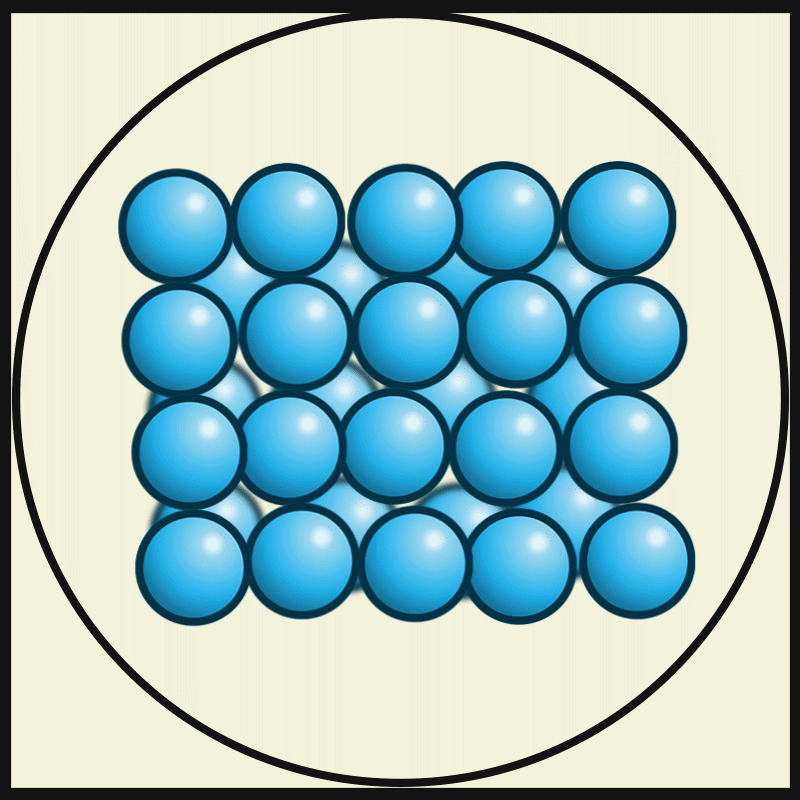
In festen Gegenständen wie Steinen oder Holz haben die Materie-Teilchen feste Plätze, an denen sie sich befinden. Aber auf ihren Plätzen schwingen sie. Und sie schwingen umso schneller, je wärmer ein fester Gegenstand ist. Umgekehrt schwingen sie natürlich umso langsamer, je kälter ein Gegenstand ist. Und bei -273,15°C bewegen sich die Materie-Teilchen gar nicht mehr. Dann können sie nicht mehr langsamer werden und deshalb gibt es auch keine tiefere Temperatur als -273,15°C.
| Die folgende Animation von Julio Miguel A Enriquez and Monica Muñoz zeigt, wie sich oberhalb des absoluten Nullpunkts von -273,15°C alle Atome um ihre festen Plätze herum bewegen. |
|
| Julio Miguel A Enriquez and Monica Muñoz, CC BY-SA 4.0 |
Mit zunehmender Temperatur bewegen sich die Teilchen immer schneller, bis die Verbindungen zwischen ihnen nicht mehr stark genug sind. Dann wechselt der Aggregatzustand des Gegenstands von fest zu flüssig.
| Die folgende Animation von Julio Miguel A Enriquez and Monica Muñoz zeigt, dass die Materie-Teilchen bei höheren Temperaturen ihre feste Plätze verlassen. In Flüssigkeiten ziehen sich aber die Materie-Teilchen noch stark genug an, um nicht ganz auseinander zu fliegen. |
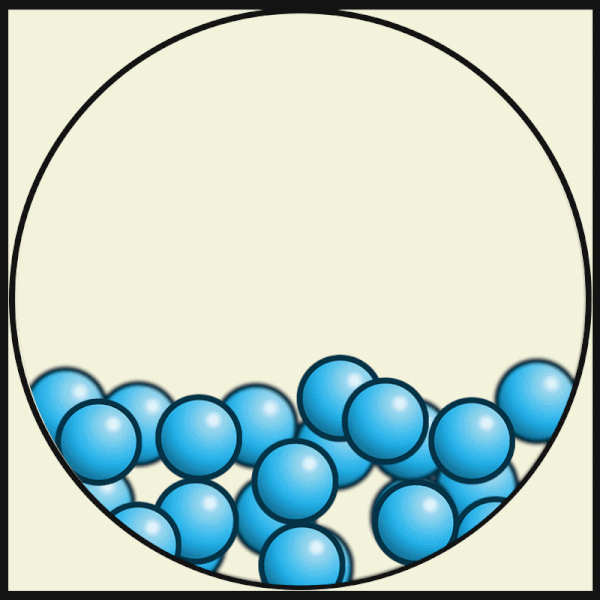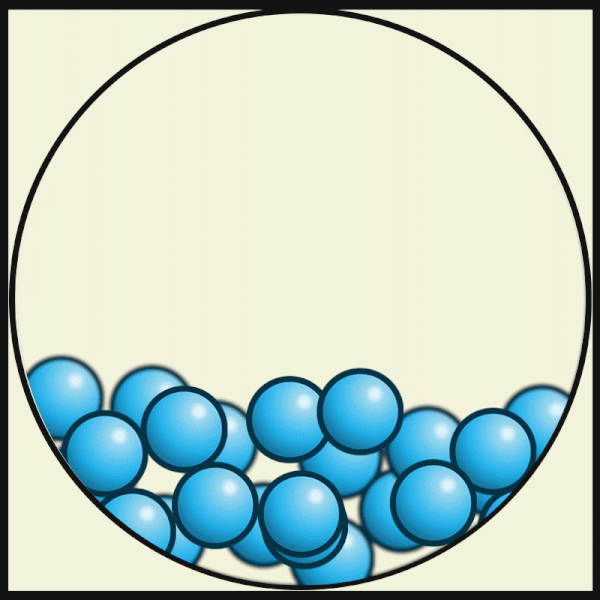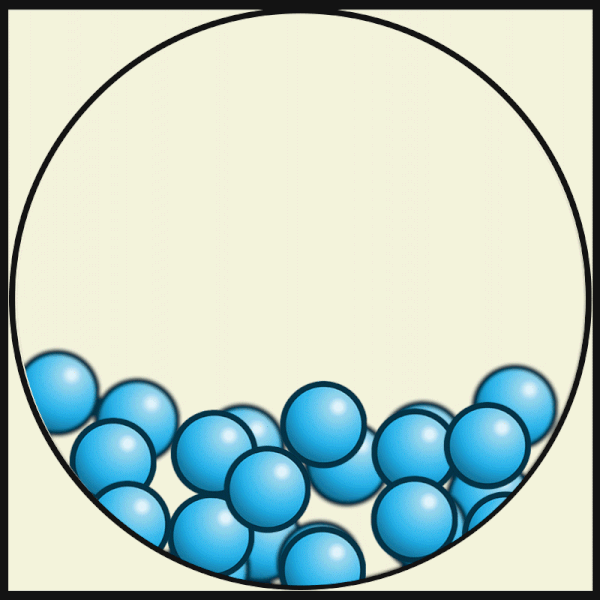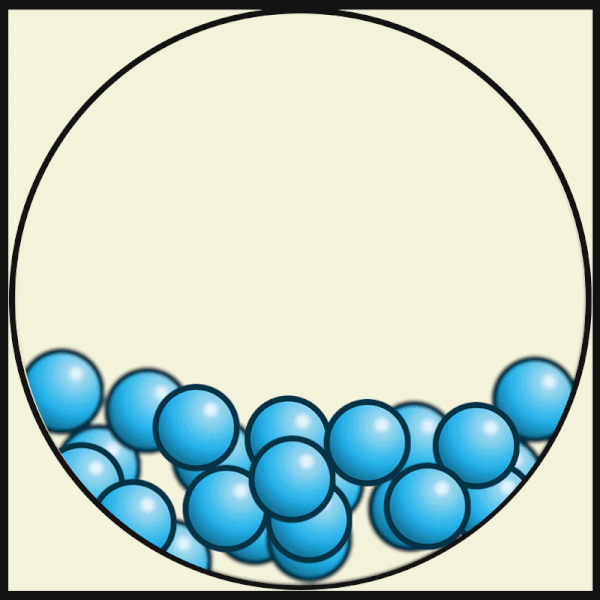
|
| Julio Miguel A Enriquez and Monica Muñoz, CC BY-SA 4.0 |
Mit weiter zunehmender Temperatur bewegen sich die Teilchen schließlich so schnell, dass es sie auch nicht mehr in der Flüssigkeit hält. Die schnellsten Teilchen fliegen aus der Flüssigkeit heraus. Die Flüssigkeit verdampft und der Aggregatzustand der Flüssigkeit wechselt von flüssig zu gasförmig.
| Bei noch höheren Temperaturen bewegen sich die Atome noch schneller und lösen sich völlig voneinander. So entsteht ein Gas. |
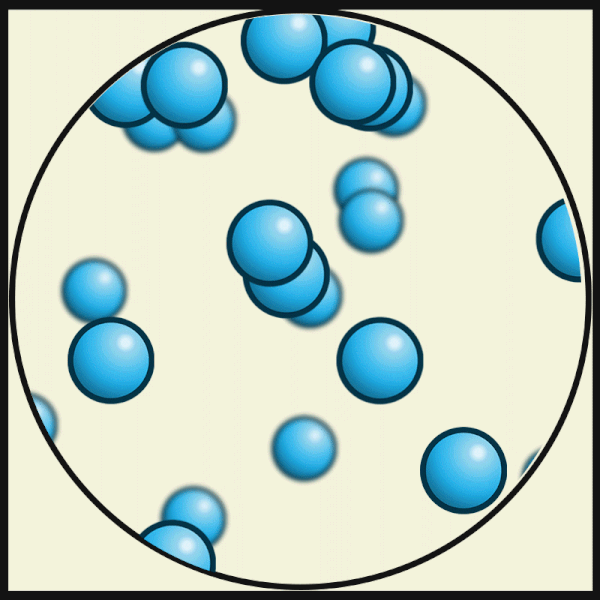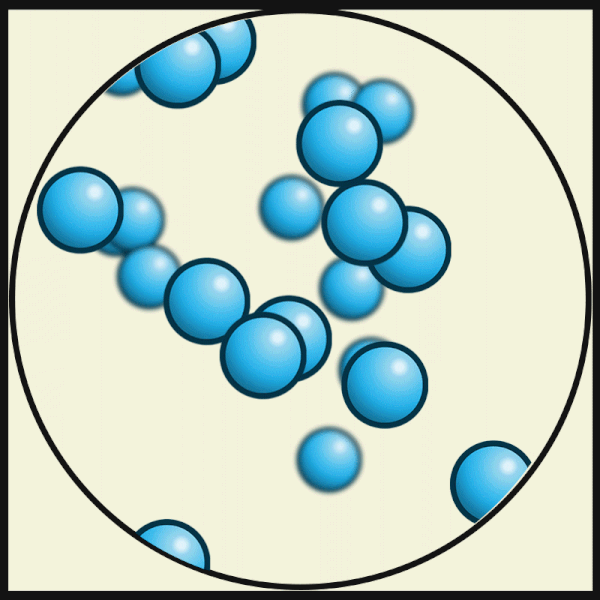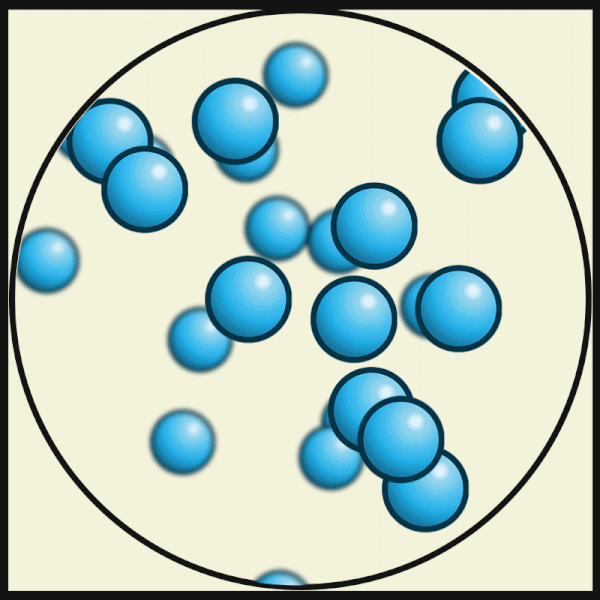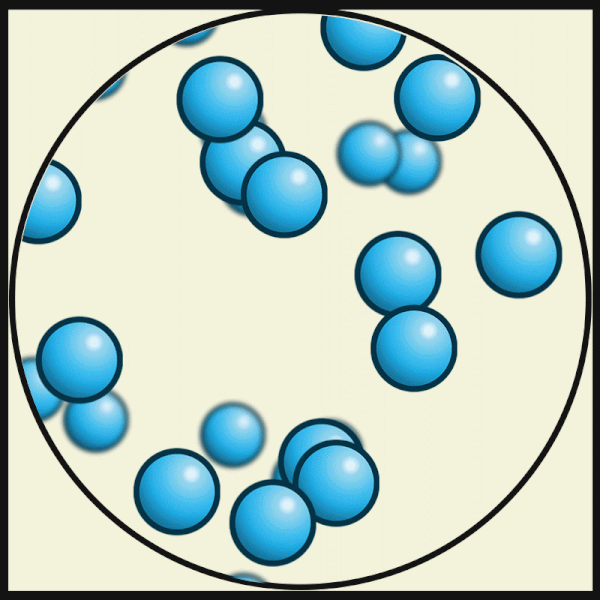
|
| Julio Miguel A Enriquez and Monica Muñoz, CC BY-SA 4.0 |
| Das folgende Schema zeigt vier Aggregatzustände und die Übergänge zwischen ihnen. |
|
|
| anonym, CC0 1.0 |
Thermometer
|
|---|
Je schneller sich die Atome in einem Festkörper, einer Flüssigkeit oder einem Gas bewegen, desto heftiger stoßen sie gegeneinander und prallen von einander ab. Dadurch entfernen sich die Materie-Teilchen umso weiter voneinander, je wärmer es wird. So kommt es, dass sich Festkörper, Flüssigkeiten und Gase bei steigenden Temperaturen normalerweise ausdehnen.
Diese Eigenschaft nutzt man in Thermometern. Man füllt einfach eine farbige Flüssigkeit in ein dünnes Glasröhrchen und befestigt das Glasröhrchen auf einer Unterlage. Dann erwärmt man das Glasröhrchen auf verschiedene Temperaturen und macht auf der Unterlage jeweils einen Strich an der Stelle, wo man die Oberkante der Flüssigkeit sieht. Denn je höher die Temperaturen ist, desto stärker dehnt sich die Flüssigkeit aus und desto höher reicht die Flüssigkeitssäule nach oben.
| Das folgende Bild zeigt ein typisches Flüssigkeits-Thermometer. |

|
| anonym, CC BY-SA 2.0 |
In der Welt der winzigen Atome treten Quanteneffekte auf.
|
|---|
| Aufgaben zur Erarbeitung des Lernstoffes bzw. zur Lernkontrolle | |
|---|---|
| g1 | Erkläre, warum sich Elektronen nicht zwischen den Elektronenschalen aufhalten können! |
| g2 | Erkläre, warum man sich Elektronen als stehende Wellen vorstellt! |
| g3 | Beschreibe, welche Eigenschaften die kleinsten Mengen von Materie und Energie gemeinsam haben! |
| g4 | Berechne die Lichtgeschwindigkeit in km/h (Kilometer pro Stunde)! |
| Hier geht es zu den Antworten. | |
Wenn ein Flugzeug mit gedrosseltem Schub zur Landung ansetzt, dann verliert es scheinbar vollkommen kontinuierlich und ohne jede erkennbare Sprunghaftigkeit ganz langsaman Geschwindigkeit und Höhe. Auch sonst kennen wir in unserer Welt der großen Dinge und Mengen fast nur kontinuierlich erscheinende Änderungen physikalischer Größen wie Geschwindigkeit, Höhe, Gewicht oder elektrische Ladung. Diese Alltagserfahrung macht es uns so schwer verständlich, daß sich die selben physikalischen Größen in der winzigen Welt der Atome in abrupten (Quanten)Sprüngen verändern. Dabei kennen wir eigentlich Effekte der kleinen Anzahl oder Menge beispielsweise vom Würfeln oder vom Umgang mit Geld, bei dem wir gelegentlich Stückelungseffekte (Quantelungen) beobachten können.
Wenn etwas viele Tausend Euro kostet, dann kann man mit dem Preis praktisch kontinuierlich rauf oder runter gehen. Einen Preis von 1 Cent muss man aber mindestens verdoppeln, weil es zwischen einem und zwei Cent einfach nichts gibt, was man austauschen könnte. Genau so kann die positive elektrische Ladung eines Atomkernes immer nur ein ganzzahliges Vielfaches der Elementarladung von 1,602×10-19 Coulomb betragen, weil jedes Proton (positiv) genau wie jedes Elektron (negativ) genau diese Elementarladung besitzt. Außerdem kann sich die Energie eines Elektrons nicht kontinuierlich ein wenig erhöhen oder reduzieren, sondern die Energie eines Elektrons kann immer nur ganz bestimmte Werte annehmen. Entspricht seine Energie der kleinstmöglichen Menge, dann kann es sich nur in der innersten Elektronenschale eines Atoms befinden. Es kann mit dieser Energie nicht in den Atomkern stürzen und auch nicht in eine höhere Elektronenschale aufsteigen. Wird aber diesem Elektron eine weitere genau passende Menge Energie zugeführt, dann kann es sich nicht mehr in der untersten Schale halten, sondern muss abrupt in die zweite Schale wechseln. Zwischen den Schalen können sich Elektronen nicht "aufhalten", weil es bei so kleinen Mengen keine feineren Stückelungen der Energieportionen gibt.
Man darf sich allerdings Elektronen nicht als wie auf Planetenbahnen um den Atomkern kreisende Teilchen vorstellen, die aufgrund einer bestimmten kinetischen Energie nicht in den Atomkern stürzen. Ein kreisendes, elektrisch geladenes Teilchen wäre nämlich ein elektrischer Strom, der ein Magnetfeld erzeugen würde, welches wiederum ein elektrisches Feld erzeugte. Würde also das Elektron des Wasserstoffs tatsächlich um dessen Proton kreisen, dann müsste es eine Strahlung aussenden und dadurch seine Energie (und Masse) einbüßen. Wasserstoff strahlt aber nicht und sein Elektron behält seine Energie. Man kann dieses Problem vermeiden, indem man Elektronen als stehende Wellen betrachtet. Dann wird weder Energie noch Masse transportiert und das Elektron kann seine Energie behalten. Stellt man sich ein Elektron als stehende Welle auf einer Kreisbahn vor, dann sind natürlich nur Bahnen möglich, deren Umfänge ganzzahlige Vielfache der Wellenlänge des jeweiligen Elektrons darstellen. Dass Elektronen nur ganz bestimmte Energieniveaus annehmen können, gilt prinzipiell auch für die allgemeinere und noch weniger anschauliche Vorstellung, daß Elektronen keine Kreisbahnen, sondern teilweise ziemlich seltsam geformte Orbitale besetzen.
Im Grunde kennen wir vom Umgang mit Geld auch das Problem, daß ein Kauf nicht zustande kommen kann, weil ein Kunde gerade nur große Geldscheine mit sich führt und der Verkäufer nicht wechseln kann. Das selbe "Problem" haben auch Elektronen, die Energie nur in für sie genau passenden Mengen aufnehmen und abgeben können, weil sie selber nur ganzzahlige Vielfache einer kleinsten Energieeinheit besitzen können. Genau wie das Elektron selber besitzt auch Energie gleichzeitig Wellen- und Teilchencharakter, kann also nur in bestimmten Portionen übertragen werden. Generell erklären die Physiker, daß Materie und Energie nicht grundverschieden, sondern sogar in einander umwandelbar sind und aus kleinsten Einheiten bestehen, die gleichzeitig Teilchen- und Wellencharakter besitzen. Diese kleinsten Einheiten in unserer makroskopischen Welt kontinuierlich erscheinender physikalischer Größen nennt man Quanten. Selbst die Übertragung von Kräften kann man sich als Austausch von Teilchen vorstellen, obwohl es dafür auch andere Erklärungsmöglichkeiten gibt. So wird zum Beispiel die elektromagnetische Kraft durch Photonen übertragen.
Auch Licht ist gequantelt.
|
|---|
Natürlich ist auch jedes Photon gleichzeitig elektromagnetische Welle und Lichtteilchen, bei denen es ebenfalls Stückelungseffekte gibt und nicht alles beliebig variieren kann. Vor allem besitzen im leeren Raum alle Photonen die selbe Geschwindigkeit von 2,9979×1010 Zentimetern pro Sekunde. Dividiert man die Lichtgeschwindigkeit c (cm/s) durch die Wellenlänge λ (cm/Schwingung) eines Photons, dann erhält man die Anzahl der Wellen, die einen bestimmten Punkt binnen einer Sekunde passieren. Man nennt diesen Wert die Frequenz ν einer Welle in Schwingungen S pro Sekunde s. Weil das Produkt aus Wellenlänge und Frequenz eines Photons der Lichtgeschwindigkeit entspricht, muss mit zunehmender Wellenlänge seine Frequenz abnehmen.
ν[S/s] = (c[cm/s]) / (λ[cm/S]) <=> c = λ x ν
Wenn Photonen auf Elektronen treffen, dann können sie nicht nur einen Teil ihrer Energie auf das Elektron übertragen. Ganz anders als wir es in unserer makroskopischen Welt kennen, kann ein Photon bei einem Zusammenstoß mit einem Elektron seine Energie nur entweder vollständig behalten oder vollständig abgeben und verschwinden.
Photonen können allerdings anders als die Elektronen eines Atoms nicht nur eine relativ kleine Anzahl ganz bestimmter Energiebeträge besitzen. Im Gegenteil können die Energiebeträge von Photonen praktisch stufenlos variieren, weil die Energie eines Photons von seiner Wellenlänge bzw. Frequenz abhängt, die über einen extrem großen Bereich stufenlos jeden beliebigen Wert annehmen können. Genau genommen können die Energiebeträge im Gegensatz zu den Wellenlängen der Photonen nicht wirklich jeden beliebigen Wert annehmen, weil sich der Energiebetrag E eines Photons aus der Multiplikation der Frequenz ν mit einer Proportionalitätskonstanten, dem sogenannten Planckschen Wirkungsquantum (h= 6,6256×10-27) ergibt (E = h x ν). Da diese Konstante nicht unendlich klein ist, verursacht sie Sprünge im Spektrum der möglichen Energiezustände von Photonen. Weil das Plancksche Wirkungsquantum aber extrem klein ist, kann man diese winzigen Sprünge normalerweise getrost vernachlässigen.
Elektromagnetische Strahlung mit praktisch stufenlos über einen sehr breiten Bereich variierenden Wellenlängen strahlen Sterne aus, aber auch Glühbirnen kommen dem Ideal des schwarzen Strahlers schon recht nahe. Insgesamt erscheint uns das Licht von Glühbirnen und der Sonne annähernd weiß und wir erkennen normalerweise nicht, daß es tatsächlich ein Gemisch unzähliger Farben bzw. Wellenlängen enthält. Das ändert sich aber, wenn wir Regenbögen sehen. In ihnen sehen wir das ganze Spektrum der sichtbaren Farben, weil Photonen mit verschiedenen Wellenlängen an den Oberflächen von Regentropfen mit etwas unterschiedlichen Winkeln reflektiert werden. Wenn gerade kein Regenbogen zur Hand ist, dann kann man zur Sichtbarmachung des Farbspektrums einer Lichtquelle auch ein Prisma benutzen.
Farben können unterschiedliche Ursachen haben.
|
|---|
|
Frau Ende hat auch zu diesem Thema ein passendes YouTube-Video von Frau Dr. Mai Thi Nguyen-Kim für Euch gefunden: |
Uns scheint die Natur sehr farbig zu sein, und das hilft uns enorm bei der Unterscheidung der verschiedenen Objekte. In Wirklichkeit empfangen allerdings unsere Augen nur unterschiedliche Spektren elektromagnetischer Wellen und reagieren auch nur auf drei sehr kleine Ausschnitte dieser meistens sehr breiten Spektren. Anstatt also die Natur wirklichkeitsgetreu abzubilden, messen die Farb-Rezeptoren in unseren Augen lediglich die Licht-Intensitäten in den Bereichen des elektromagnetischen Spektrums, die wir blau, grün und rot nennen. Die Meßergebnisse werden als Nerven-Impulse zum Gehirn geleitet, wo aus der praktisch unendlich großen Anzahl möglicher Kombinationen unterschiedlicher Intensitäten dieser drei Grundfarben die uns bekannte Farbenvielfalt berechnet wird. Selbst dieses sehr selektive Herauspicken blauer, grüner und roter Farben funktioniert nur am Tag bei ausreichend hohen Licht-Intensitäten. Nachts reicht hierfür die Sensitivität der Zapfen unserer Retina nicht aus und wir sehen mit den 1000-fach lichtempfindlicheren Stäbchen nur noch Hell-Dunkel-Unterschiede.
Die Farben nicht selber leuchtender Objekte.
|
|---|
Nicht selber leuchtende Objekte sind für uns sichtbar, weil sie das Licht leuchtender Objekte nicht perfekt spiegeln oder unvollständig durchscheinen lassen. Vielmehr absorbieren (Pigmentfarben) sie einen Teil des Lichtes, oder sie zerlegen (Strukturfarben) es wie ein Prisma.
Die Farben selber leuchtender Objekte.
|
|---|
Leuchtende Objekte können entweder selbst Energie freisetzen und diese als elektromagnetische Strahlung abstrahlen, oder sie werden durch Photonen mit genau passenden Energieinhalten angeregt und strahlen dann selbst in der zunächst aus dem Licht-Spektrum heraus gefilterten Farbe. Fällt das anregende Licht gleichmäßig aus allen Richtungen auf solche Objekte, dann ist dieser Effekt nicht erkennbar, weil Licht-Absorption und Licht-Emission sich genau ergänzen. Passiert aber beispielsweise das Licht eines Sterns auf dem langen Weg in unsere Augen einen Nebel, dann fehlen anschließend dem Licht-Spektrum des Sterns die absorbierten Frequenzen. Denn während der größte Teil des Licht dieses Sterns seinen Weg in der ursprünglichen Richtung weiter fortsetzen kann, verteilt sich das von dem zum Leuchten gebrachten Gas emitierte Licht gleichmäßig in alle Richtungen. Deshalb leuchtet das Gas nur in dieser einen Farbe, wenn ein Beobachter den Nebel ohne direkt durch ihn hindurch gehendes Licht sieht.
Die Welt der Atome kann man nicht heimlich beobachten.
|
|---|
Das normale Leben in unserer großen Welt vermittelt uns den Eindruck, man könne die Dinge durch Beobachtung erforschen, ohne sie dabei zu beeinflussen. Tatsächlich spielt es ja beispielsweise für ein in 10 Kilometern Höhe fliegendes Flugzeug überhaupt keine Rolle, ob sein Flug von niemandem, wenigen oder vielen Menschen beobachtet wird. Auf das Flugzeug hat es keinen Einfluß, ob das von seinen Oberflächen reflektierte Licht in den Weltraum entschwindet, vom Erdboden verschluckt wird oder auf die Netzhaut eines Menschen fällt.
Je kleiner aber ein Objekt ist, umso kürzer müssen auch die Wellenlängen des Lichtes oder allgemeiner ausgedrückt der elektromagnetischen Strahlung sein, damit sie von dem Objekt reflektiert werden. Lange Radiowellen mit Wellenlängen oberhalb eines Kilometers eignen sich zum Beispiel nicht zur Darstellung eines deutlich kleineren Flugzeuges. Uns stört das nicht, solange es von der Sonne mit dem relativ kurzwelligen sichtbaren Licht beschienen wird. Nachts können wir Flugzeuge zur Beobachtung auch mit Radarwellen bestrahlen, ohne damit ihren Flug zu beeinflussen oder ihre Passagiere zu verletzen. Aber sichtbares Licht besitzt je nach Farbe Wellenlängen zwischen 4000 und 8000 Angström und ist damit um vier Größenordnungen zu langwellig, um damit Atome zu untersuchen.
Je kürzer aber die Wellenlängen elektromagnetischer Strahlung werden, desto höher ist ihre Energie und umso gravierender ist ihr Einfluß auf das zu beobachtende Objekt. Die für eine Untersuchung von Atomen erforderliche Strahlung ist tödlich und zerstört oder bewegt zumindest kleine Untersuchungsobjekte. Deshalb wird beispielsweise die Flugbahn eines Elektrons durch den Versuch seiner Beobachtung massiv beeinflusst und lässt sich demnach auch nicht beobachten.
Diffusion und Osmose
|
|---|
Ebenfalls sehr wichtig für das Verständnis von Chemie und Biologie sind die physikalischen Phänomene Diffusion und Osmose. Klausurartige Aufgaben für die selbständige Erarbeitung befinden sich im Übungsmodul Diffusion und Osmose. Die Informationen und Erklärungen befinden sich im Lerntext Diffusion und Osmose.
Kommentare und Kritik von Fachleuten, Lernenden und deren Eltern sind jederzeit willkommen.
Roland Heynkes, CC BY-NC-SA 4.0